Occurrence and risk factors of vascular calcification in 110 maintenance hemodialysis patients
-
摘要:目的
观察行维持性血液透析治疗慢性肾衰竭(CRF)患者的血管钙化发生情况,并分析相关影响因素。
方法选取在河北省邢台市中心医院行维持性血液透析治疗的110例CRF患者为研究对象。通过髋关节、腹部及双手X线片检查明确患者是否存在血管钙化,并根据钙化结果将患者分为钙化组(n=59, 轻、中、重度钙化)与非钙化组(n=51,无钙化)。比较2组一般资料和实验室指标[白细胞(WBC)计数、血红蛋白(Hb)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、白蛋白(ALB)、血钾(K)、血钙(Ca)、血磷(P)、血肌酐(SCr)、尿素氮(BUN)、尿酸(UA)、全段甲状旁腺激素(iPTH)、超敏C反应蛋白(hs-CRP)、白细胞介素-13(IL-13)、成纤维细胞生长因子23(FGF23)、骨硬化蛋白(SOST)], 并通过Logistic回归分析筛选血管钙化的影响因素。
结果钙化组与非钙化组在性别、体质量指数、吸烟史及肾脏原发病方面比较,差异均无统计学意义(P>0.05)。钙化组平均年龄、透析龄高于非钙化组,差异有统计学意义(P < 0.05)。钙化组与非钙化组WBC、Hb、TC、TG、HDL-C、LDL-C、K、Ca、BUN水平比较,差异均无统计学意义(P>0.05)。与非钙化组相比,钙化组ALB、UA水平更低,P、SCr、iPTH、hs-CRP、IL-13、FGF23及SOST水平更高,差异有统计学意义(P < 0.05)。多因素Logistic回归分析显示,年龄、透析龄以及P、iPTH、IL-13、FGF23和SOST水平均是患者发生血管钙化的影响因素(P < 0.05)。受试者工作特征曲线显示,IL-13、FGF23、SOST对患者血管钙化均有一定的诊断价值[曲线下面积(AUC)均>0.7], 且IL-13、FGF23、SOST联合诊断的效能高于三者单独诊断(AUC=0.911, P < 0.05)。
结论血管钙化在行维持性血液透析治疗的CRF患者中较常见,年龄、透析龄、P、IL-13、FGF23、SOST等是血管钙化的影响因素。
Abstract:ObjectiveTo observe the incidence of vascular calcification in patients with chronic renal failure (CRF) undergoing maintenance hemodialysis and analyze the related influencing factors.
MethodsA total of 110 CRF patients undergoing maintenance hemodialysis at Xingtai Central Hospital in Hebei Province were selected. Vascular calcification was determined through hip, abdominal, and bilateral hand X-ray examinations, and patients were divided into calcification group (n=59, with mild, moderate, and severe calcification) and non-calcification group (n=51, without calcification) based on the calcification results. General information and laboratory indicators [white blood cell (WBC) count, hemoglobin (Hb), total cholesterol (TC), triglycerides (TG), high-density lipoprotein cholesterol (HDL-C), low-density lipoprotein cholesterol (LDL-C), albumin (LB), serum potassium (K), serum calcium (Ca), serum phosphorus (P), serum creatinine (SCr), urea nitrogen (BUN), uric acid (UA), intact parathyroid hormone (iPTH), high-sensitivity C-reactive protein (hs-CRP), interleukin-13 (IL-13), fibroblast growth factor 23 (FGF23), sclerostin (SOST)]were compared between the two groups, and Logistic regression analysis was performed to screen influencing factors of vascular calcification.
ResultsThere were no statistically significant differences in gender, body mass index, smoking history, and primary renal diseases between the calcification and non-calcification groups(P>0.05). The mean age and dialysis duration were higher in the calcification group compared to the non-calcification group (P < 0.05). There were no statistically significant differences in WBC, Hb, TC, TG, HDL-C, LDL-C, K, Ca, and BUN levels between the two groups (P>0.05). Compared with the non-calcification group, the calcification group had lower ALB and UA levels and higher P, SCr, iPTH, hs-CRP, IL-13, FGF23, and SOST levels(P < 0.05). Multivariate Logistic regression analysis showed that age, dialysis duration, and levels of P, iPTH, IL-13, FGF23, and SOST were influencing factors for vascular calcification in patients (P < 0.05). The receiver operating characteristic curve indicated that IL-13, FGF23, and SOST had certain diagnostic value for vascular calcification in patients [area under the curve (AUC) >0.7], and the diagnostic efficacy of combined IL-13, FGF23, and SOST was higher than that of each indicator alone (AUC=0.911, P < 0.05).
ConclusionVascular calcification is common in CRF patients undergoing maintenance hemodialysis, and age, dialysis duration, P, IL-13, FGF23, and SOST are influencing factors for vascular calcification.
-
随着血液净化技术的不断进步,维持性血液透析使越来越多的肾病患者得以长期生存。慢性肾衰竭(CRF)患者通过维持性血液透析延长生存期,但随着肾小球滤过率下降及钙磷代谢失调的发生,血管钙化风险显著增加[1]。血管钙化已被证实是多种心血管疾病的诱因,同时也是CRF患者死亡的重要危险因素。研究[2]表明,血管钙化并非钙盐的被动沉积,而是一个可调控的病理过程。因此,了解维持性血液透析患者血管钙化的影响因素,特别是与血管钙化调控相关的细胞因子,对于早期预测血管钙化发生、准确评估血管钙化程度具有重要意义。本研究探讨维持性血液透析患者血管钙化的影响因素,旨在为临床诊疗工作提供有益参考。
1. 对象与方法
1.1 研究对象
采用回顾性研究设计,选取本院在2022年2月—2024年2月接受维持性血液透析治疗的110例CRF患者为研究对象。纳入标准: ①年龄18~85岁者; ②符合CRF诊断标准[3]者; ③经维持性血液透析规律治疗6个月以上者; ④有完整实验室及影像学检查资料者。排除标准: ①有急性肾损伤、恶性肿瘤、严重脑血管病者; ②处于炎症性疾病活动期者; ③有冠状动脉支架植入手术史者; ④伴有心律失常者; ⑤近期有急、慢性感染病史或应用过激素类药物/免疫抑制剂者; ⑥近3个月内发生急性心血管事件,或有重大手术、创伤病史者; ⑦伴有软组织钙化者。根据血管钙化评分结果,将研究对象分为钙化组(n=59, 轻、中、重度钙化)与非钙化组(n=51, 无钙化)。患者对本研究知情同意,并签署知情同意书。
1.2 方法
1.2.1 资料收集与指标检测
收集2组患者的临床资料,包括: ①基础信息: 性别、年龄、体质量指数(BMI)、透析龄、吸烟史、肾脏原发病; ②实验室指标: 白细胞(WBC)计数、血红蛋白(Hb)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、白蛋白(ALB)、血钾(K)、血钙(Ca)、血磷(P)、血肌酐(SCr)、尿素氮(BUN)、尿酸(UA)、全段甲状旁腺激素(iPTH)、超敏C反应蛋白(hs-CRP)、白细胞介素-13(IL-13)、成纤维细胞生长因子23(FGF23)、骨硬化蛋白(SOST)。2组患者均接受标准碳酸氢盐维持性血液透析治疗,仪器选用高通量聚砜膜透析器,膜面积1.6~1.9 mm2, 血流量200~300 mL/min, 每周透析2~3次,每次4 h。采集患者晨起空腹静脉血,离心处理后保留血清标本对上述指标进行检测, FGF23、SOST检测采用酶联免疫吸附试验, IL-13检测采用双抗夹心酶联免疫吸附试验,其余生化指标(WBC、Hb、TC、TG、Ca、P等)的检测采用全自动生化分析仪。
1.2.2 血管钙化评估[4]
采用髋关节、腹部及双手X线片检查所有患者股动脉、桡动脉、手动脉、腹主动脉的血管钙化情况并进行评估。评估方法: X线片被股骨头切面水平线、脊柱垂直线分为4个部分,被掌骨上方水平线、左右手分隔垂直线分为4个部分,被腰椎L2、L3椎间隙水平线分为上、下2个部分。对上述各部分钙化情况进行评分(无钙化计0分,有钙化计1分),所有部分得分之和即为血管钙化总评分。总评分0分为无钙化, 1~3分为轻度钙化, 4~6分为中度钙化, 7~8分为重度钙化。
1.3 观察指标
① 比较2组基线资料、实验室指标; ②分析维持性血液透析患者发生血管钙化的影响因素; ③分析IL-13、FGF23、SOST诊断血管钙化的效能。
1.4 统计学方法
采用SPSS 25.0进行统计学分析。计数资料以[n(%)]表示,比较行χ2检验,符合正态分布的计量资料以(x±s)表示,组间比较采用独立样本t检验,采用二元Logistic回归分析筛选血管钙化的危险因素,通过绘制受试者工作特征(ROC)曲线分析IL-13、FGF23、SOST对血管钙化的诊断效能, P < 0.05为差异有统计学意义。
2. 结果
2.1 一般资料比较
血管钙化评估结果显示, 110例患者中, 59例存在血管钙化, 51例无钙化,血管钙化发生率为53.64%。钙化组与非钙化组在性别、BMI、吸烟史及肾脏原发病方面比较,差异无统计学意义(P>0.05)。钙化组平均年龄、透析龄高于非钙化组,差异有统计学意义(P < 0.05), 见表 1。
表 1 钙化组与非钙化组一般资料比较(x±s)[n(%)]指标 分类 钙化组(n=59) 非钙化组(n=51) χ2/t P 性别 男 33(55.93) 31(60.78) 0.265 0.607 女 26(44.07) 20(39.22) 年龄/岁 64.55±6.72 56.14±8.17 5.923 < 0.001 透析龄/月 48.94±6.87 35.05±7.40 10.203 < 0.001 体质量指数/(kg/m2) 22.82±2.41 23.06±1.86 0.578 0.565 吸烟史 有 23(38.98) 18(30.51) 0.159 0.689 无 36(61.02) 33(55.93) 肾脏原发病 糖尿病肾病 13(22.03) 12(20.34) 0.394 0.942 慢性肾小球肾炎 26(44.07) 22(37.29) 高血压肾病 9(15.25) 6(10.17) 多囊肾 6(10.17) 5(8.47) 其他 5(8.47) 6(10.17) 2.2 钙化组与非钙化组的实验室指标比较
钙化组与非钙化组WBC、Hb、TC、TG、HDL-C、LDL-C、K、Ca、BUN水平比较,差异无统计学意义(P>0.05)。与非钙化组相比,钙化组ALB、UA水平较低, P、SCr、iPTH、hs-CRP、IL-13、FGF23及SOST水平较高,差异有统计学意义(P < 0.05), 见表 2。
表 2 钙化组与非钙化组实验室指标比较(x±s)指标 钙化组(n=59) 非钙化组(n=51) t P WBC/(×109/L) 6.12±1.07 5.94±1.76 0.441 0.660 Hb/(g/L) 116.74±23.69 114.88±20.46 0.437 0.663 TC/(mmol/L) 4.48±0.78 4.34±0.97 0.839 0.404 TG/(mmol/L) 1.92±0.41 1.88±0.57 0.426 0.671 HDL-C/(mmol/L) 1.08±0.33 1.11±0.42 0.419 0.676 LDL-C/(mmol/L) 2.56±0.68 2.49±0.71 0.527 0.599 ALB/(g/L) 39.41±6.52 43.67±7.96 3.085 0.003 K/(mmol/L) 4.81±0.73 4.75±0.61 0.463 0.644 Ca/(mmol/L) 2.15±0.44 2.20±0.63 0.488 0.627 P/(mmol/L) 2.18±0.51 1.65±0.62 4.918 < 0.001 SCr/(μmol/L) 1 154.37±280.54 938.58±245.36 4.262 < 0.001 BUN/(mmol/L) 27.32±5.68 28.49±7.03 0.965 0.337 UA/(μmol/L) 448.87±84.52 520.64±95.63 4.178 < 0.001 iPTH/(pg/mL) 495.48±58.74 264.59±60.48 20.278 < 0.001 hs-CRP/(mg/L) 2.40±0.38 1.87±0.55 5.942 < 0.001 IL-13/(ng/L) 26.59±3.76 17.52±3.91 12.385 < 0.001 FGF23/(ng/L) 165.84±16.74 112.97±20.30 14.968 < 0.001 SOST/(pmol/L) 126.84±23.76 92.43±20.49 8.068 < 0.001 WBC: 白细胞; Hb: 血红蛋白; TC: 总胆固醇; TG: 甘油三酯; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; ALB: 白蛋白; K: 钾; Ca: 钙; P: 磷; SCr: 血肌酐; BUN: 尿素氮; UA: 尿酸; iPTH: 全段甲状旁腺激素; hs-CRP: 超敏C反应蛋白; IL-13: 白细胞介素-13; FGF23: 成纤维细胞生长因子23; SOST: 硬化蛋白。 2.3 CRF患者发生血管钙化的影响因素
以单因素分析中差异有统计学意义的指标作为自变量,以CRF患者是否发生血管钙化为因变量,进行多因素Logistic回归分析。结果显示,年龄、透析龄、P、iPTH、IL-13、FGF23和SOST均是血管钙化的危险因素(P < 0.05), 见表 3。
表 3 维持性血液透析患者发生血管钙化的影响因素分析因素 β SE Wald P OR 95%CI 年龄 0.722 0.246 8.614 0.021 2.059 1.107~4.647 透析龄 0.603 0.194 9.661 0.015 1.828 1.032~3.695 ALB 0.533 0.362 2.168 0.073 1.704 0.992~2.864 UA -0.367 0.284 1.699 0.082 0.693 0.975~2.443 P 0.637 0.278 5.250 0.035 1.891 1.202~3.861 SCr 0.492 0.301 2.672 0.066 1.636 0.983~2.687 iPTH 0.651 0.284 5.254 0.031 1.917 1.086~3.337 hs-CRP 0.542 0.339 2.556 0.068 1.719 0.941~2.874 IL-13 0.503 0.199 6.389 0.029 1.654 1.101~3.141 FGF23 0.715 0.276 6.711 0.021 2.044 1.083~2.960 SOST 0.703 0.311 5.110 0.037 2.019 1.007~3.925 2.4 IL-13、FGF23、SOST对血管钙化的诊断效能
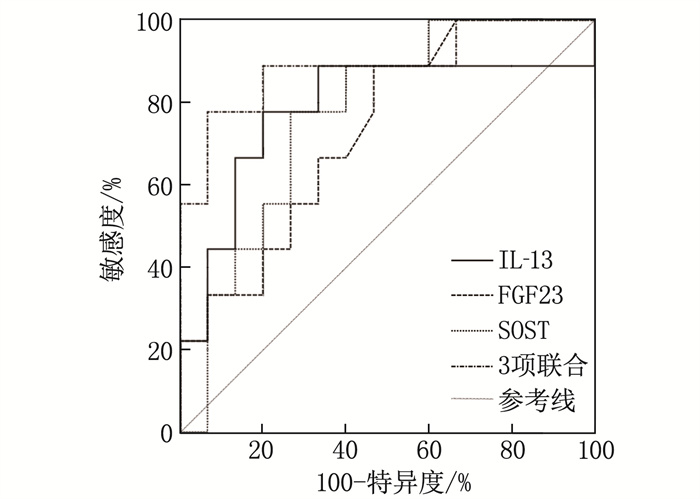
绘制IL-13、FGF23、SOST及3项联合诊断血管钙化的ROC曲线(图 1)。结果显示, IL-13、FGF23、SOST对患者血管钙化均有一定的诊断价值,曲线下面积(AUC)均>0.7, IL-13、FGF23、SOST联合对血管钙化的诊断效能高于各指标单独诊断(Z=2.374、2.588、2.934, P < 0.05), 见表 4。
表 4 IL-13、FGF23、SOST对血管钙化的诊断效能指标 AUC cut-off值 95%CI 敏感度/% 特异度/% IL-13 0.781 20.52 ng/L 0.768~0.901 65.68 92.32 FGF23 0.754 130.87 ng/L 0.723~0.874 76.83 68.43 SOST 0.726 105.24 pmol/L 0.656~0.861 64.42 83.97 3项联合 0.911 — 0.864~0.967 88.74 70.49 3. 讨论
维持性血液透析是临床最常用的肾脏替代疗法,但临床统计数据显示,心血管疾病仍是导致维持性血液透析患者死亡的重要因素。临床证据表明,心血管事件的发生与血管钙化密切相关,因此,血管钙化有望成为预测心血管死亡风险的因素之一。血管钙化主要表现为血管壁变硬、顺应性下降,而血管内径通常无明显改变[5], 其生理、病理机制主要为成骨细胞相关蛋白基因表达增加,导致血管平滑肌细胞及血管壁内的血源性细胞在钙化因子的作用下转变为成骨细胞,进而促进血管钙化[6]。相关研究[7]指出,血管钙化现象在维持性血液透析患者中普遍存在,且其中很大部分患者伴心血管钙化。本研究中, 59例(53.64%)患者存在血管钙化,略低于徐建男等[8]报道的发生率,但仍表明血管钙化在维持性血液透析患者中十分常见。因此,关注这类患者的血管钙化情况对于评估其预后具有重要意义。
本研究结果显示,与非钙化组比较,钙化组平均年龄、透析龄更大,钙化组ALB、UA水平更低, P、SCr、iPTH、hs-CRP、IL-13、FGF23及SOST水平更高。Logistic回归分析显示,年龄、透析龄、P、iPTH、IL-13、FGF23和SOST均是血管钙化的影响因素。既往研究[9]指出,透析患者发生血管钙化的一个重要因素为年龄。本研究多因素分析结果也显示,年龄、透析龄是患者发生血管钙化的影响因素。多数维持性血液透析患者机体处于高血磷状态,主要与维持性血液透析患者丧失肾功能、导致正常血磷代谢受阻有关。研究认为,高磷血症会使维持性血液透析患者血管钙化发生风险增加,与本研究结果基本相符。经多因素Logistic回归分析证实,血P是血管钙化的影响因素[10]。这可能是因为,高磷血症可促使动脉血管平滑肌细胞分化为成骨表型,促使矿物质沉积,且磷酸盐还可影响磷酸钠通道,促使血管钙化[11]。iPTH能调节钙磷代谢,高磷和低钙均可刺激iPTH分泌, iPTH则可在其他因子共同作用下刺激肾脏-甲状旁腺-骨轴,进而影响骨转换过程。长期高iPTH状态还可同时调节基因转录,进而加快血管钙化[12]。本研究结果显示, iPTH是患者发生血管钙化的影响因素。
本研究结果还显示,钙化组血清IL-13、FGF23及SOST水平高于非钙化组, IL-13、FGF23和SOST均是患者发生血管钙化的影响因素,与陈雨等[13]报道结论基本一致。FGF23是一种钙磷代谢调节因子,主要由骨细胞、成骨细胞分泌,人血清FGF23含量稳定,但在CRF早期血磷水平会发生代偿性升高。研究[14]认为,机体微炎症可诱导肝脏分泌钙化抑制因子,通过抑制胎球蛋白A的分泌影响钙磷代谢。此外,炎症还可对内皮细胞产生损害,促进钙化斑块形成。IL-13是由辅助T细胞分泌的一种具有抗炎作用的炎症因子,在机体细胞免疫功能发生异常时,IL-13表达会明显上调。维持性血液透析患者长期处于微炎症状态,介导微炎症状态的血清IL-13呈高表达状态,参与血管钙化进程。SOST可抑制成骨细胞生成,影响骨形成, CRF患者因肾小球滤过功能下降,血清SOST水平会显著升高。研究[15]指出,钙化血管中可检测SOST分泌增加,认为SOST虽能抑制钙化沉积,但因肾功能受损、钙化血管原位SOST分泌增多,所以仍能检测到血清SOST水平升高,且血清SOST水平与血管钙化进程一致。ROC曲线显示,血清IL-13、FGF23及SOST均可用于血管钙化诊断,且3项联合诊断效能较好。该结果与罗静等[16]报道结果基本相符,提示IL-13、FGF23及SOST可能参与CRF患者发生血管钙化的过程,可作为预测血管钙化发生的血清学指标。
综上所述,血管钙化在行维持性血液透析治疗的CRF患者中较常发生,年龄、透析龄、P、IL-13、FGF23、SOST等均是血管钙化的影响因素。血清IL-13、FGF23及SOST变化可为临床早期诊断血管钙化提供参考依据。临床应高度关注以上影响因素,并积极采取相应干预措施,以减缓血管钙化进程。
-
表 1 钙化组与非钙化组一般资料比较(x±s)[n(%)]
指标 分类 钙化组(n=59) 非钙化组(n=51) χ2/t P 性别 男 33(55.93) 31(60.78) 0.265 0.607 女 26(44.07) 20(39.22) 年龄/岁 64.55±6.72 56.14±8.17 5.923 < 0.001 透析龄/月 48.94±6.87 35.05±7.40 10.203 < 0.001 体质量指数/(kg/m2) 22.82±2.41 23.06±1.86 0.578 0.565 吸烟史 有 23(38.98) 18(30.51) 0.159 0.689 无 36(61.02) 33(55.93) 肾脏原发病 糖尿病肾病 13(22.03) 12(20.34) 0.394 0.942 慢性肾小球肾炎 26(44.07) 22(37.29) 高血压肾病 9(15.25) 6(10.17) 多囊肾 6(10.17) 5(8.47) 其他 5(8.47) 6(10.17) 表 2 钙化组与非钙化组实验室指标比较(x±s)
指标 钙化组(n=59) 非钙化组(n=51) t P WBC/(×109/L) 6.12±1.07 5.94±1.76 0.441 0.660 Hb/(g/L) 116.74±23.69 114.88±20.46 0.437 0.663 TC/(mmol/L) 4.48±0.78 4.34±0.97 0.839 0.404 TG/(mmol/L) 1.92±0.41 1.88±0.57 0.426 0.671 HDL-C/(mmol/L) 1.08±0.33 1.11±0.42 0.419 0.676 LDL-C/(mmol/L) 2.56±0.68 2.49±0.71 0.527 0.599 ALB/(g/L) 39.41±6.52 43.67±7.96 3.085 0.003 K/(mmol/L) 4.81±0.73 4.75±0.61 0.463 0.644 Ca/(mmol/L) 2.15±0.44 2.20±0.63 0.488 0.627 P/(mmol/L) 2.18±0.51 1.65±0.62 4.918 < 0.001 SCr/(μmol/L) 1 154.37±280.54 938.58±245.36 4.262 < 0.001 BUN/(mmol/L) 27.32±5.68 28.49±7.03 0.965 0.337 UA/(μmol/L) 448.87±84.52 520.64±95.63 4.178 < 0.001 iPTH/(pg/mL) 495.48±58.74 264.59±60.48 20.278 < 0.001 hs-CRP/(mg/L) 2.40±0.38 1.87±0.55 5.942 < 0.001 IL-13/(ng/L) 26.59±3.76 17.52±3.91 12.385 < 0.001 FGF23/(ng/L) 165.84±16.74 112.97±20.30 14.968 < 0.001 SOST/(pmol/L) 126.84±23.76 92.43±20.49 8.068 < 0.001 WBC: 白细胞; Hb: 血红蛋白; TC: 总胆固醇; TG: 甘油三酯; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; ALB: 白蛋白; K: 钾; Ca: 钙; P: 磷; SCr: 血肌酐; BUN: 尿素氮; UA: 尿酸; iPTH: 全段甲状旁腺激素; hs-CRP: 超敏C反应蛋白; IL-13: 白细胞介素-13; FGF23: 成纤维细胞生长因子23; SOST: 硬化蛋白。 表 3 维持性血液透析患者发生血管钙化的影响因素分析
因素 β SE Wald P OR 95%CI 年龄 0.722 0.246 8.614 0.021 2.059 1.107~4.647 透析龄 0.603 0.194 9.661 0.015 1.828 1.032~3.695 ALB 0.533 0.362 2.168 0.073 1.704 0.992~2.864 UA -0.367 0.284 1.699 0.082 0.693 0.975~2.443 P 0.637 0.278 5.250 0.035 1.891 1.202~3.861 SCr 0.492 0.301 2.672 0.066 1.636 0.983~2.687 iPTH 0.651 0.284 5.254 0.031 1.917 1.086~3.337 hs-CRP 0.542 0.339 2.556 0.068 1.719 0.941~2.874 IL-13 0.503 0.199 6.389 0.029 1.654 1.101~3.141 FGF23 0.715 0.276 6.711 0.021 2.044 1.083~2.960 SOST 0.703 0.311 5.110 0.037 2.019 1.007~3.925 表 4 IL-13、FGF23、SOST对血管钙化的诊断效能
指标 AUC cut-off值 95%CI 敏感度/% 特异度/% IL-13 0.781 20.52 ng/L 0.768~0.901 65.68 92.32 FGF23 0.754 130.87 ng/L 0.723~0.874 76.83 68.43 SOST 0.726 105.24 pmol/L 0.656~0.861 64.42 83.97 3项联合 0.911 — 0.864~0.967 88.74 70.49 -
[1] 王新梓, 邱溢博, 邓雨, 等. 维持性血液透析患者血管钙化治疗的研究进展[J]. 实用临床医药杂志, 2022, 26(22): 144-148. doi: 10.7619/jcmp.20221784 [2] 张玉霞, 汤日宁, 刘必成. 慢性肾脏病患者血管钙化发生机制研究进展[J]. 中华肾脏病杂志, 2021, 37(9): 779-784. doi: 10.3760/cma.j.cn441217-20200817-00115 [3] 何立群, 许筠, 孙伟, 等. 慢性肾衰竭诊疗指南[J]. 中国中医药现代远程教育, 2011, 9(9): 132-133. [4] ADRAGAO T, PIRES A, LUCAS C, et al. A simple vascular calcification score predicts cardiovascular risk in haemodialysis patients[J]. Nephrol Dial Transplant, 2004, 19(6): 1480-1488.
[5] 杨雪晴, 侯静波. AGEs通过引起内皮细胞间充质转化导致血管钙化的机制[J]. 心血管康复医学杂志, 2022, 31(2): 223-226. [6] 梁英权, 段亚君, 韩际宏. 血管钙化分子机制研究进展[J]. 中国动脉硬化杂志, 2020, 28(11): 921-929. [7] 李丹妮, 朱士彦, 罗承志. 慢性肾脏病合并心血管疾病患者血液透析治疗对微炎症因子及血管钙化的影响[J]. 海南医学, 2021, 32(13): 1652-1654. [8] 徐建男, 王淑明, 张建新, 等. 维持性血液透析患者血清GRP78、BMP2水平及其与血管钙化的相关性[J]. 中国血液净化, 2023, 22(4): 254-258. [9] 宋玉环, 郎佳慧, 李苹苹, 等. 维持性血液透析患者腹主动脉钙化特点及影响因素分析[J]. 临床肾脏病杂志, 2020, 20(12): 951-954. [10] 陈钦, 郑昌志, 何祥琨. 维持性血液透析患者的血磷水平与冠状动脉钙化的关系研究[J]. 临床内科杂志, 2022, 39(6): 390-391. [11] KERYAKOS H K H, OKAILY N I, BOULIS M A Y, et al. Osteocalcin and vascular calcification in hemodialysis patients: an observational cohort study[J]. Int Urol Nephrol, 2021, 53(5): 1015-1023.
[12] 陈宇, 王德琴, 缪娴静, 等. 维持性血液透析患者血清骨桥蛋白、成纤维细胞生长因子23与血管钙化的关系[J]. 检验医学, 2024, 39(7): 656-660. [13] 陈雨, 李旻, 周华, 等. 维持性血液透析患者血清IGF-1、SOST与血管钙化的关系[J]. 山东医药, 2020, 60(25): 85-88. [14] 陈惠霞, 王玮玮, 党珊, 等. 血清HO-1、HIF-1α及FGF23对腹膜透析患者血管钙化的影响[J]. 中国血液净化, 2023, 22(8): 574-578. [15] 钟杰, 安春兰, 张家丽. 维持性血液透析患者血清骨硬化蛋白、骨桥蛋白的表达及其与血管钙化的相关性[J]. 中国血液净化, 2022, 21(7): 502-506. [16] 罗静, 王琰, 张瑞, 等. 慢性肾衰竭血液透析患者IL-13、FGF23、SOST水平变化与血管钙化的关系[J]. 西南医科大学学报, 2024, 47(4): 325-329.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
