Effects of microRNA-455-3p on airway smooth muscle cells in asthmatic rats by regulating toll-like receptor 4
-
摘要:目的
探讨微小RNA-455-3p(miR-455-3p)对哮喘大鼠气道平滑肌细胞(ASMC)增殖、凋亡及炎症因子分泌功能的影响及可能机制。
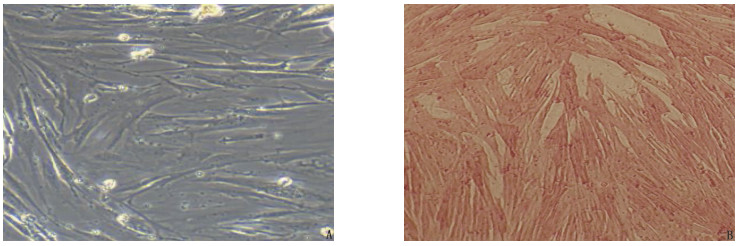
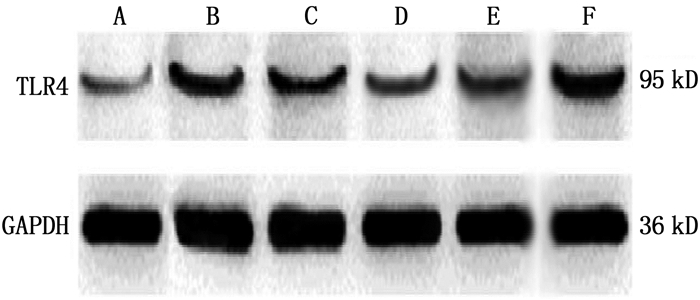
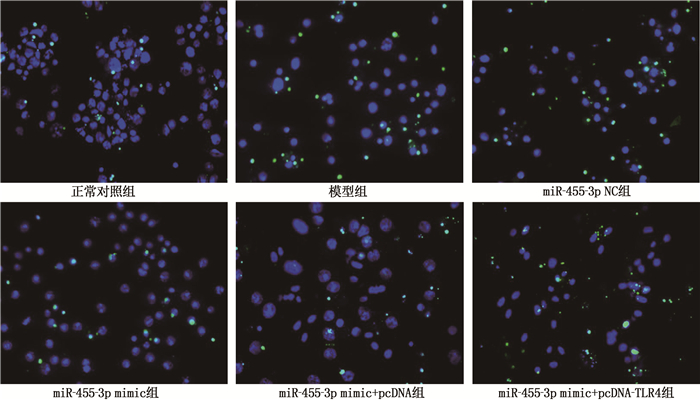
方法建立卵清蛋白(OVA)诱导的哮喘大鼠模型(模型组),同时设立正常对照组(正常大鼠,等量生理盐水),采用实时荧光定量聚合酶链反应(qRT-PCR)检测2组大鼠肺组织miR-455-3p表达水平; 采用酶联免疫吸附试验(ELISA)检测肺组织和血清中炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)水平。分离大鼠ASMC,采用双荧光素酶报告基因实验验证miR-455-3p与Toll样受体4(TLR4)的靶向关系; 使用TNF-α刺激哮喘大鼠ASMC产生炎症反应。通过Lip2000转染法转染miR-455-3p NC(miR-455-3p NC组)、miR-455-3p mimic(miR-455-3p mimic组)和共转染miR-455-3p mimic与pcDNA(miR-455-3p mimic+pcDNA组)、miR-455-3p mimic与pcDNA-TLR4(miR-455-3p mimic+pcDNA-TLR4组)于哮喘大鼠炎症ASMC, 另设正常对照组(正常大鼠ASMC)和模型组(哮喘大鼠炎症ASMC), 采用四甲基偶氮唑蓝(MTT)法检测细胞增殖情况,采用原位末端标记法(TUNEL)检测细胞凋亡情况,采用ELISA检测细胞上清液中TNF-α、IL-6水平,采用qRT-PCR和免疫印迹法(WB)分别检测miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平。
结果模型组大鼠肺组织中miR-455-3p表达水平低于正常对照组,且肺组织与血清中TNF-α、IL-6表达水平均高于正常对照组,差异有统计学意义(P < 0.05)。双荧光素酶报告基因实验结果显示, miR-455-3p可直接靶向抑制TLR4基因表达。与正常对照组相比,模型组大鼠ASMC中miR-455-3p表达水平、ASMC增殖活性降低, TLR4 mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平升高,差异有统计学意义(P < 0.05); 与miR-455-3p NC组相比, miR-455-3p mimic组ASMC中miR-455-3p表达水平、ASMC增殖活性升高, TLR4 mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平降低,差异有统计学意义(P < 0.05); 与miR-455-3p mimic+pcDNA组比较, miR-455-3p mimic+pcDNA-TLR4组ASMC中miR-455-3p表达水平、ASMC增殖活性降低, TLR4 mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平升高,差异有统计学意义(P < 0.05)。
结论miR-455-3p可通过靶向抑制TLR4表达,减轻哮喘大鼠ASMC炎症反应,调节其增殖与凋亡平衡。
Abstract:ObjectiveTo investigate the effects of microRNA-455-3p (miR-455-3p) on the proliferation, apoptosis and secretion function of inflammatory factors of airway smooth muscle cells (ASMC) in asthmatic rats and its possible mechanism.
MethodsThe ovalbumin (OVA)-induced asthmatic rat model (model group) and the normal control group (normal rats with the same amount of normal saline) were established. The expression level of miR-455-3p in lung tissue was detected by real-time fluorescent quantitative PCR (qRT-PCR), the tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) levels in lung tissue and serum were detected by Enzyme-linked immunosorbent assay (ELISA). Rat ASMC were isolated, double luciferase reporter gene assay was used to verify the targeting relationship between miR-455-3p and toll like receptor 4 (TLR4). TNF-α was used to stimulate the ASMC of asthmatic rats to produce inflammation. The Lip2000 transfection method was used to transfect miR-455-3p NC (miR-455-3p NC group), miR-455-3p mimic (miR-455-3p mimic group), and co-transfect miR-455-3p mimic and pcDNA (miR-455-3p mimic+pcDNA group), miR-455-3p mimic and pcDNA-TLR4 (miR-455-3p mimic+ pcDNA-TLR4 group) to inflammatory ASMC of asthmatic rats. ASMC of normal rats was set as normal control group, and ASMC with inflammation of asthmatic rats was set as model group. Methyl thiazolyl tetrazolium (MTT) assay was used to detect cell proliferation, apoptosis was detected by terminal dexynucleotidyl transferase-mediated dUTP nick end labeling (TUNEL), the levels of TNF-α and IL-6 in the supernatant were detected by ELISA, in addition, the expression levels of miR-455-3p, TLR4 mRNAs and TLR4 protein were detected by qRT-PCR and western blot (WB).
ResultsCompared with the normal control group, the expression of miR-455-3p in the lung tissue of the model group was significantly reduced, and the levels of TNF-α and IL-6 in the lung tissue and serum were significantly increased (P < 0.05). Double luciferase reporter gene assay showed that miR-455-3p could directly target and inhibit TLR4 gene expression. Compared with the normal control group, the expression level of miR-455-3p in ASMC and the proliferation activity of ASMC reduced significantly, and the expression levels of TLR4 mRNA and TLR4 protein, apoptosis rate and TNF-α and IL-6 levels in ASMC supernatant increased significantly in the model group (P < 0.05); compared with the miR-455-3p NC group, the expression level of miR-455-3p and the proliferation activity of ASMC increased significantly, TLR4 mRNA and TLR4 protein expression levels, apoptosis rate and TNF-α and IL-6 levels in ASMC supernatant were significantly reduced in the miR-455-3p mimic group(P < 0.05); compared with miR-455-3p mimic+pcDNA group, miR-455-3p expression level and ASMC proliferation activity in ASMC reduced significantly, TLR4 mRNA and TLR4 protein expression levels, apoptosis rate and TNF-α and IL-6 levels in ASMC supernatant increased significantly in miR-455-3p mimic+pcDNA-TLR4 group (P < 0.05).
ConclusionMiR-455-3p can relieve the inflammatory response and regulate the balance of proliferation and apoptosis of ASMC in asthmatic rats by targeted inhibition of the expression of TLR4.
-
Keywords:
- asthma /
- rats /
- airway smooth muscle cells /
- microRNA-455-3p /
- toll-like receptor 4 /
- proliferation /
- apoptosis /
- inflammation
-
胃癌是消化系统常见的恶性肿瘤,在中国病死率居高不下,其治疗以外科手术为主,为保证术后效果、预防复发,常辅助化疗[1-2]。因肿瘤消耗、机体代谢需求变大、外科手术创伤等因素引起营养素大量消耗,易致机体发生营养不良[3-4]。部分肿瘤患者直接死于营养不良,而非肿瘤疾病本身[5]。营养不良是胃癌化疗患者的常见问题,如果不及时干预,可导致不良结局事件的发生。故规范科学的营养支持是胃癌化疗患者治疗不可或缺的部分。营养状况筛查与评估工具可客观评估机体营养状况,明确其可能的影响因素,并加以针对性干预。准确预测胃癌化疗患者营养不良风险对改善其预后具有重要意义。列线图常用于临床事件个体化风险预测[6]。相关研究[7]利用列线图模型预测慢性心力衰竭患者营养不良风险,预测效率和临床适用性较好。鉴于此,本研究通过分析胃癌化疗患者营养不良的危险因素,构建预测胃癌化疗患者营养不良风险的列线图模型。
1. 资料与方法
1.1 一般资料
选择2021年1月—2022年12月在本院肿瘤科接受完整化疗的152例患者为研究对象。纳入标准: ①行胃癌根治性切除术者; ②接受完整术后化疗者; ③年龄>18岁者; ④自愿接受本研究问卷调查者。排除标准: ①出现腹腔或肝脏等远处转移者; ②术前接受新辅助化疗者; ③患精神病,或无法正常沟通者; ④入院之前已发生营养不良者; ⑤合并其他肠胃疾病史患者。本研究获本院伦理委员会批准。
1.2 方法
1.2.1 收集资料
收集患者年龄、性别、文化程度、居住地、家庭月收入、合并糖尿病、合并高血压、肿瘤部位、分化程度、分期、术式、T分期和神经脉管侵犯、区域淋巴结转移、化疗期间肠外营养支持、总蛋白缺乏、低蛋白血症、贫血、食欲、恶心、呕吐、口干、便秘、腹泻、早饱等资料。
1.2.2 化疗方案
本研究对象选择的化疗方案主要有2种。①奥沙利铂(85 mg, 静脉滴注)+5-氟尿嘧啶(400 mg, 静脉滴注)+亚叶酸钙(200 mg, 静脉滴注)。②奥沙利铂(130 mg, 静脉滴注)+替吉奥(40 mg, 口服)。
1.2.3 化疗护理管理
护士遵医嘱给予患者胃肠减压、补液、禁食等对症护理措施,同时加强患者的血压、心率等生命体征监测; 给予患者口腔护理,妥善固定胃管,避免打折、滑脱、弯曲等现象发生,并详细记录患者引流液的数量、质量、颜色。同时保持病房干净,维持适宜的温度及湿度,并鼓励患者运动,增加运动量及日常活动的频次,为患者制订饮食食谱等。
1.2.4 营养状况评估
营养状况评估采用自评-主观全面评定量表(PG-SGA)。该量表包括患者自我评估、医务人员评估2个部分,分值为0分(营养状况好)至35分(营养状况差)[8]。依据定量评估结果分为营养良好组(得分<4分)与营养不良组(得分≥4分)[9-10]。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。计数资料采用[n(%)]描述,行卡方检验。以胃癌化疗患者营养状况为因变量(营养良好=0, 营养不良=1), 将其年龄、性别、文化程度、居住地等为自变量纳入胃癌化疗患者营养不良的相关影响因素分析,采用单因素分析相关因素,将单因素分析差异有统计学意义的变量纳入二分类Logistic回归分析,以明确胃癌化疗患者营养不良的独立危险因素。将胃癌化疗患者营养不良的独立危险因素引入R3.6.3软件及rms程序包,构建预测胃癌化疗患者营养不良发生风险的列线图模型,使用受试者工作特征(ROC)曲线、校准曲线验证列线图模型的区分度与一致性; 采用Hosmer-Lemeshow拟合优度检验评价列线图模型的拟合优度。P<0.05表示差异有统计学意义。
2. 结果
2.1 一般资料分析
152例胃癌化疗患者中, 106例营养不良,发生率为69.74%。营养良好组(n=46)与营养不良组(n=106)在合并糖尿病、合并高血压、肿瘤部位、分化程度、分期、术式、T分期、有无神经脉管侵犯、有无区域淋巴结转移、有无总蛋白缺乏、有无食欲、有无呕吐、有无口干、有无便秘、有无腹泻方面比较,差异无统计学意义(P>0.05), 在年龄、性别、文化程度、居住地、家庭月收入、化疗期间肠外营养支持、有无低蛋白血症、有无贫血、有无恶心、有无早饱方面比较,差异有统计学意义(P<0.05)。见表 1。
表 1 2组一般资料分析[n(%)]一般资料 分类 营养良好组(n=46) 营养不良组(n=106) χ2 P 年龄 <60岁 35(76.09) 55(51.89) 7.779 0.005 ≥60岁 11(23.91) 51(48.11) 性别 男 24(52.17) 77(72.64) 6.028 0.014 女 22(47.83) 29(27.36) 文化程度 小学及以下 8(17.39) 38(35.85) 11.394 0.010 初中 9(19.57) 32(30.19) 高中/中专 20(43.48) 26(24.53) 大专及以上 9(19.57) 10(9.43) 居住地 城市 32(69.57) 50(47.17) 6.476 0.011 农村 14(30.43) 56(52.83) 家庭月收入 <3 000元人民币 7(15.22) 28(26.42) 8.429 0.015 3 000~5 000元人民币 18(39.13) 54(50.94) >5 000元人民币 21(45.65) 24(22.64) 合并糖尿病 是 32(69.57) 62(58.49) 1.667 0.197 否 14(30.43) 44(41.51) 合并高血压 是 29(63.04) 59(55.66) 0.717 0.397 否 17(36.96) 47(44.34) 肿瘤部位 贲门 12(26.09) 23(21.70) 0.389 0.823 胃体 24(52.17) 57(53.77) 胃窦 10(21.74) 26(24.53) 分化程度 中分化 6(13.04) 10(9.43) 0.444 0.505 低分化 40(86.96) 96(90.57) 分期 Ⅰ期 10(21.74) 26(24.53) 0.593 0.743 Ⅱ期 14(30.43) 26(24.53) Ⅲ期 22(47.83) 54(50.94) 术式 近端胃切除术 1(2.17) 2(1.89) 0.151 0.927 全胃切除术 27(58.70) 59(55.66) 远胃切除术 18(39.13) 45(42.45) T分期 T1~T3 39(84.78) 96(90.57) 1.080 0.299 T4 7(15.22) 10(9.43)) 神经脉管侵犯 有 33(71.74) 72(67.92) 0.219 0.640 无 13(28.26) 34(32.08) 区域淋巴结转移 有 34(73.91) 70(66.04) 0.921 0.337 无 12(26.09) 36(33.96) 化疗期间肠外营养支持 是 31(67.39) 45(42.45) 7.980 0.005 否 15(32.61) 61(57.55) 总蛋白缺乏 无 39(84.78) 79(74.53) 1.942 0.163 有 7(15.22) 27(25.47) 低蛋白血症 无 45(97.83) 90(84.91) 5.391 0.020 有 1(2.17) 16(15.09) 贫血 无 28(60.87) 44(41.51) 4.823 0.028 有 18(39.13) 62(58.49) 食欲 无 4(8.70) 23(21.70) 3.713 0.054 有 42(91.30) 83(78.30) 恶心 无 43(93.48) 82(77.36) 5.706 0.017 有 3(6.52) 24(22.64) 呕吐 无 42(91.30) 91(85.85) 0.873 0.350 有 4(8.70) 15(14.15) 口干 无 44(95.65) 93(87.74) 2.260 0.133 有 2(4.35) 13(12.26) 便秘 无 45(97.83) 94(88.68) 3.432 0.064 有 1(2.17) 12(11.32) 腹泻 无 43(93.48) 101(95.28) 0.210 0.647 有 3(6.52) 5(4.72) 早饱 无 45(97.83) 87(82.08) 6.965 0.008 有 1(2.17) 19(17.92) 2.2 多因素Logistic回归分析
Logistic回归分析结果显示,性别男(95%CI: 1.232~6.292, P=0.014)、化疗期间未肠外营养支持(95%CI: 1.528~7.781, P=0.003)、有低蛋白血症(95%CI: 1.193~76.786, P=0.033)、有早饱(95%CI: 1.259~82.652, P=0.030)是胃癌化疗患者营养不良的独立危险因素,见表 2。
表 2 多因素Logistic回归分析因素 赋值说明 B S. E Wals P Exp (B) 95%CI 下限 上限 性别(1) 女=0, 男=1 1.024 0.416 6.056 0.014 2.784 1.232 6.292 化疗期间肠外营养支持(1) 是=0, 否=1 1.238 0.415 8.882 0.003 3.448 1.528 7.781 有无低蛋白血症(1) 无=0, 有=1 2.259 1.062 4.521 0.033 9.572 1.193 76.786 有无早饱(1) 无=0, 有=1 2.322 1.067 4.733 0.030 10.201 1.259 82.652 常量 — -0.697 0.396 3.096 0.078 0.498 — — 2.3 列线图模型建立
将性别、化疗期间肠外营养支持、有无低蛋白血症、有无早饱4项预测指标引入R软件,构建预测胃癌化疗患者营养不良发生风险的列线图模型,见图 1。预测胃癌化疗患者营养不良发生风险的列线图模型评分表见表 3。
表 3 列线图模型评分表分列线图中的预测变量 分类 列线图评分/分 性别 女 0 男 44.2 化疗期间肠外营养支持 是 0 否 52.9 低蛋白血症 无 0 有 97.3 早饱 无 0 有 100.0 2.4 内部验证
区分度评价: 列线图模型预测的ROC曲线下面积为0.757(95%CI: 0.680~0.833), 见图 2。一致性评价: 校准曲线斜率接近1, 且Hosmer-Lemeshow拟合优度检验显示χ2=5.834, P=0.442。
3. 讨论
营养是维持正常生命活动的物质基础[11]。对胃癌患者而言,良好的营养状况可提高机体耐受性,保证外科手术、辅助化疗的顺利实施,还可改善其预后。化疗是治疗癌症的有效手段之一,通过全身或局部使用化学药物可有效杀灭肿瘤细胞[12]。机体营养状态与化疗往往是相互影响的,营养不良可降低机体对化疗的耐受性,而临床使用的化疗药物通常具有细胞毒性,常引起胃肠反应等,不利于机体营养摄入,加剧营养不良程度[13-14]。本研究采用PG-SGA评估胃癌化疗患者的营养状况,结果显示, 152例胃癌化疗患者中, 106例营养不良,发生率为69.74%, 这与毛玲红等[15]进行的关于肺癌患者化疗期间营养不良调查研究结果接近。可见,胃癌化疗患者营养不良发生率较高。
本研究采用Logistic回归分析筛选影响胃癌化疗患者营养不良的危险因素,结果显示,性别男(95%CI: 1.232~6.292, P=0.014)、化疗期间未肠外营养支持(95%CI: 1.528~7.781, P=0.003)、有低蛋白血症(95%CI: 1.193~76.786, P=0.033)、有早饱(95%CI: 1.259~82.652, P=0.030)是胃癌化疗患者营养不良的独立危险因素。本研究构建的预测胃癌化疗患者营养不良风险的列线图模型,基于上述胃癌化疗患者营养不良的4项独立危险因素。性别是胃癌化疗患者营养不良影响因素,这可能是因为男性胃癌高发,且部分男性有经常加班熬夜、酗酒、抽烟等不良生活习惯。肠外营养支持系指经静脉途径提供机体所需营养物质,是消化道肿瘤患者常用的营养支持方法。本研究认为,化疗期间未肠外营养支持是胃癌化疗患者营养不良影响因素,这与张瑜等[16]、屈清荣等[17]研究结果一致,提示要加强胃癌化疗患者的肠外营养支持,以改善机体营养状况。本研究中,有低蛋白血症是胃癌化疗患者营养不良的独立危险因素,与毕研霞等[18]研究结果类似。推测其原因可能是:白蛋白能有效清除活性氧,增强机体免疫力,白蛋白合成进程受到显著抑制,将引起机体低蛋白血症,导致细胞免疫损伤,增加营养不良风险。胃癌化疗期间要重视患者机体白蛋白检测,依据检测结果适时补充能量、蛋白质,以满足机体所需营养。早饱,也就是功能性消化不良,此种情况下胃排空速度较缓,食物摄入量远低于正常进食量[19]。根据本研究分析结果,早饱对胃癌化疗患者营养状况有直接影响,为胃癌化疗患者营养不良的独立危险因素之一。分析原因可能与食物摄入量远低于正常进食量有关,长期食物摄入量过少将无法满足机体营养所需,营养供给不足自然会引起营养不良。因此,护理人员可对胃癌化疗患者进行必要的饮食指导,可通过健康讲座、宣传手册等形式加深患者对健康饮食知识的了解。本研究采用校准曲线验证列线图模型的一致性,采用Hosmer-Lemeshow拟合优度检验评价列线图模型的拟合优度,结果显示χ2=5.834, P=0.442。本研究构建的列线图预测模型的预测结果与胃癌化疗患者营养不良实际发生率较吻合,准确度较高。ROC曲线下面积为0.757(95%CI: 0.680~0.833), 说明该列线图模型区分度较好,可有效预测胃癌化疗患者营养不良。
列线图模型可节省计算过程,且更易理解,能够直观看到胃癌化疗患者营养不良的独立危险因素及相应权重,以便引起临床医护人员的重视,根据各预测变量展开针对性干预,还能够强化胃癌化疗患者对营养不良的认知,进而改善其营养状态。根据本研究分析结果,临床上应对性别男、化疗期间未肠外营养支持、有低蛋白血症、有早饱等因素的胃癌化疗患者给予重视,进行科学营养支持,以减少胃癌化疗患者营养不良的发生。本研究尚存在以下不足: ①仅在一家医院收集病例,样本量较小,不同地区患者营养状况可能不同; ②纳入分析的影响因素有限; ③列线图模型构建后未进行外部验证。后续还需通过多中心、大样本的临床前瞻性横断面研究进行验证,并纳入更多影响因素进行分析以筛选出更高效的预测指标,进一步优化列线图模型并进行外部验证。
综上所述,男性、化疗期间未肠外营养支持、有低蛋白血症、有早饱是胃癌化疗患者营养不良的独立危险因素,基于此构建的预测列线图模型具有良好的区分度与一致性,可为临床评估胃癌化疗患者营养不良风险提供依据。
-
表 1 2组大鼠肺组织、血清中炎性因子水平比较(x±s)
ng/L 组别 n 肺组织 血清 TNF-α IL-6 TNF-α IL-6 正常对照组 6 43.44±4.55 35.25±3.67 9.16±0.94 18.29±1.97 模型组 6 75.43±7.64* 48.36±4.95* 17.34±1.87* 25.43±2.64* TNF-α: 肿瘤坏死因子-α; IL-6: 白细胞介素-6。与正常对照组比较, *P < 0.05。 表 2 荧光素酶报告基因检测miR-455-3p与TLR4的靶向关系(x±s)
组别 n 相对荧光素酶活性 miR-455-3p NC+WT-TLR4组 6 1.03±0.12* miR-455-3p mimics+MUT-TLR4组 6 0.96±0.10* miR-455-3p NC+MUT-TLR4组 6 1.08±0.11* miR-455-3p mimics+WT-TLR4组 6 0.35±0.06 miR-455-3p: 微小RNA-455-3p; TLR4: Toll样受体4;
WT: 野生型; MUT: 突变型。
与miR-455-3p mimics+WT-TLR4组比较, *P < 0.05。表 3 各组大鼠ASMC中miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平比较(x±s)
组别 n miR-455-3p TLR4 mRNA TLR4蛋白 正常对照组 6 1.07±0.11 0.98±0.10 0.07±0.01 模型组 6 0.61±0.07* 4.22±0.45* 0.30±0.05* miR-455-3p NC组 6 0.58±0.06* 4.19±0.42* 0.32±0.04* miR-455-3p mimic组 6 0.76±0.08#△ 1.93±0.21#△ 0.18±0.03#△ miR-455-3p mimic+pcDNA组 6 0.79±0.08#△ 1.95±0.20#△ 0.16±0.02#△ miR-455-3p mimic+pcDNA-TLR4组 6 0.21±0.03▲ 6.87±0.69▲ 0.67±0.08▲ 与正常对照组比较, *P < 0.05; 与模型组比较, #P < 0.05; 与miR-455-3p NC组比较, △P < 0.05;
与miR-455-3p mimic+pcDNA组比较, ▲P < 0.05。表 4 各组大鼠ASMC增殖活性(OD)、凋亡率比较(x±s)
组别 n OD 凋亡率/% 正常对照组 6 0.74±0.08 6.21±0.68 模型组 6 0.49±0.07* 9.52±0.97* miR-455-3p NC组 6 0.47±0.05* 9.58±1.01* miR-455-3p mimic组 6 0.71±0.10#△ 6.56±0.67#△ miR-455-3p mimic+pcDNA组 6 0.78±0.09#△ 6.79±0.71#△ miR-455-3p mimic+pcDNA-TLR4组 6 0.34±0.06▲ 10.21±1.05▲ 与正常对照组比较, *P < 0.05; 与模型组比较, #P < 0.05; 与miR-455-3p NC组比较, △P < 0.05;
与miR-455-3p mimic+pcDNA组比较, ▲P < 0.05。表 5 各组大鼠ASMC上清液TNF-α、IL-6水平比较(x±s)
ng/L 组别 n TNF-α IL-6 正常对照组 6 421.85±47.39 10.25±1.07 模型组 6 1 224.33±127.58* 17.19±1.85* miR-455-3p NC组 6 1 221.86±135.69* 18.21±1.92* miR-455-3p mimic组 6 439.27±46.74#△ 10.98±1.11#△ miR-455-3p mimic+pcDNA组 6 487.95±49.12#△ 12.24±1.37#△ miR-455-3p mimic+pcDNA-TLR4组 6 1 363.52±149.93▲ 17.89±1.85▲ 与正常对照组比较, *P < 0.05; 与模型组比较, #P < 0.05; 与miR-455-3p NC组比较, △P < 0.05;
与miR-455-3p mimic+pcDNA组比较, ▲P < 0.05。 -
[1] 许花芬, 冯琼, 李春蕾. 支气管哮喘患儿基质金属蛋白酶-16、自噬相关基因5和自噬相关基因7的表达及其与肺功能的相关性[J]. 实用临床医药杂志, 2022, 26(9): 35-39. doi: 10.7619/jcmp.20214839 [2] ZHOU H, WU Q, WEI L, et al. Paeoniflorin inhibits PDGF-BB-induced human airway smooth muscle cell growth and migration[J]. Mol Med Rep, 2018, 17(2): 2660-2664.
[3] WANG H, YAO H, YI B, et al. microRNA-638 inhibits human airway smooth muscle cell proliferation and migration through targeting cyclin D1 and NOR1[J]. J Cell Physiol, 2018, 234(1): 369-381.
[4] FANG L, WANG X, SUN Q, et al. IgE downregulates PTEN through microRNA-21-5p and stimulates airway smooth muscle cell remodeling[J]. Int J Mol Sci, 2019, 20(4): E875. doi: 10.3390/ijms20040875
[5] WU J, LIU J, DING Y, et al. miR-455-3p suppresses renal fibrosis through repression of ROCK2 expression in diabetic nephropathy[J]. Biochem Biophys Res Commun, 2018, 503(2): 977-983. doi: 10.1016/j.bbrc.2018.06.105
[6] ZHOU C, CHEN Y, KANG W, et al. miR-455-3p-1 represses FGF7 expression to inhibit pulmonary arterial hypertension through inhibiting the RAS/ERK signaling pathway[J]. J Mol Cell Cardiol, 2019, 130: 23-35. doi: 10.1016/j.yjmcc.2019.03.002
[7] XU X, LI H. Integrated microRNA gene analysis of coronary artery disease based on miRNA and gene expression profiles[J]. Mol Med Rep, 2016, 13(4): 3063-3073. doi: 10.3892/mmr.2016.4936
[8] HE Y, LOU X, JIN Z, et al. Mahuang Decoction mitigates airway inflammation and regulates IL-21/STAT3 signaling pathway in rat asthma model[J]. J Ethnopharmacol, 2018, 224: 373-380. doi: 10.1016/j.jep.2018.06.011
[9] 苏海英, 莫碧文, 韦江红, 等. TLR4在气道上皮细胞诱导的哮喘气道平滑肌细胞迁移中的作用[J]. 中国应用生理学杂志, 2012, 28(2): 103-106. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGSL201202002.htm [10] LI Z, MENG Q, PAN A, et al. microRNA-455-3p promotes invasion and migration in triple negative breast cancer by targeting tumor suppressor EI24[J]. Oncotarget, 2017, 8(12): 19455-19466. doi: 10.18632/oncotarget.14307
[11] CHENG F, HU H Y, SUN K F, et al. miR-455-3p enhances chondrocytes apoptosis and inflammation by targeting COL2A1 in the in vitro osteoarthritis model[J]. Biosci Biotechnol Biochem, 2020, 84(4): 695-702. doi: 10.1080/09168451.2019.1690974
[12] SUN Y, WANG Y, YANG H, et al. miR-455-3p functions as a tumor suppressor in colorectal cancer and inhibits cell proliferation by targeting TPT1[J]. Int J Clin Exp Pathol, 2018, 11(5): 2522-2529.
[13] TORABI S, TAMADDON M, ASADOLAHI M, et al. miR-455-5p downregulation promotes inflammation pathways in the relapse phase of relapsing-remitting multiple sclerosis disease[J]. Immunogenetics, 2019, 71(2): 87-95. doi: 10.1007/s00251-018-1087-x
[14] CHO M, LEE J E, LIM H, et al. Fibrinogen cleavage products and Toll-like receptor 4 promote the generation of programmed cell death 1 ligand 2-positive dendritic cells in allergic asthma[J]. J Allergy Clin Immunol, 2018, 142(2): 530-541, e6. doi: 10.1016/j.jaci.2017.09.019
[15] SHANG L, WANG L, SHI X, et al. HMGB1 was negatively regulated by HSF1 and mediated the TLR4/MyD88/NF-κB signal pathway in asthma[J]. Life Sci, 2020, 241: 117120. doi: 10.1016/j.lfs.2019.117120
[16] 王涛, 韩娜. siRNA沉默凋亡抑制蛋白基因对支气管哮喘小鼠气道平滑肌增殖的影响[J]. 重庆医学, 2016, 45(16): 2186-2189, 2193. https://www.cnki.com.cn/Article/CJFDTOTAL-CQYX201616009.htm [17] QU D, LING Z, TAN X, et al. High mobility group protein B1(HMGB1) interacts with receptor for advanced glycation end products (RAGE) to promote airway smooth muscle cell proliferation through ERK and NF-κB pathways[J]. Int J Clin Exp Pathol, 2019, 12(9): 3268-3278.
-
期刊类型引用(1)
1. 邱换换,葛高琪,郭瑾,刘建芳,路亚婉. 基于主观整体营养评估量表评分的营养干预对结直肠癌患者化疗期营养摄入和生活质量的影响. 国际医药卫生导报. 2025(01): 136-140 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:



 苏公网安备 32100302010246号
苏公网安备 32100302010246号