Correlation between expression of ovarian tumor domain-containing ubiquitin aldehyde binding protein 1 and programmed cell death-ligand 1 in non-small cell lung cancer
-
摘要:目的
探讨非小细胞肺癌(NSCLC)中卵巢肿瘤泛素异肽酶1(OTUB1)与程序性死亡受体-1配体(PD-L1)的相关性。
方法分析肿瘤基因组数据库(TCGA)中NSCLC与癌旁正常组织OTUB1 mRNA的差异性。基于基因表达谱数据动态分析(GEPIA)探讨NSCLC中OTUB1与PD-L1 mRNA表达相关性。免疫组化法检测46例NSCLC及41例癌旁正常组织蜡块OTUB1及PD-L1蛋白表达,收集临床病例数据及随访资料。分析OTUB1在癌组织与癌旁组织中的表达差异,OTUB1与PD-L1相关性、临床病理特征的关系以及无复发生存期(RFS)预测意义。
结果NSCLC与癌旁正常组织的OTUB1 mRNA及蛋白表达差异均有统计学意义(P < 0.05)。NSCLC的OTUB1与PD-L1 mRNA无相关性(P>0.05),但两者蛋白表达有相关性(P=0.029)。OTUB1与TNM分期有相关性(P=0.039),与年龄、吸烟史、分化程度、转移淋巴结数及病理类型无相关性(P>0.05)。Kaplan-Meier分析显示,TNM分期(P < 0.001)、转移淋巴结数(P=0.001)及分化程度(P=0.042)是RFS的影响因素;OTUB1阴性及阳性中位RFS分别是18、19个月,差异无统计学意义(P>0.05)。COX多因素分析结果提示,分化程度(P=0.005)及TNM分期(P=0.006)是影响RFS的独立危险因素。
结论NSCLC中OTUB1 mRNA及蛋白表达均高于癌旁正常组织。在蛋白水平方面,OTUB1与PD-L1呈正相关。OTUB1表达与TNM分期相关。
-
关键词:
- 非小细胞肺癌 /
- 卵巢肿瘤泛素异肽酶1 /
- 程序性死亡受体-1配体 /
- 免疫治疗 /
- 相关性
Abstract:ObjectiveTo explore the correlation between ovarian tumor domain-containing ubiquitin aldehyde binding protein 1 (OTUB1) and programmed cell death-ligand 1 (PD-L1) in non-small cell lung cancer (NSCLC).
MethodsDifferences of OTUB1 mRNA between NSCLC and corresponding non-tumor normal tissues in the Cancer Genome Atlas (TCGA) were analyzed. The correlation on mRNA expression between OTUB1 and PD-L1 in NSCLC in Gene Expression Profiling Interactive Analysis (GEPIA) was discussed. The protein expressions of OTUB1 and PD-L1 in 46 cases of NSCLC and 41 cases of corresponding non-tumor normal tissues were detected by immunohistochemistry, and the clinical case data and follow-up data were collected. The expression difference of OTUB1 between cancer tissues and adjacent tissues, the correlations between OTUB1 and PD-L1 as well as clinicopathological features, and the predictive significance for recurrence free survival (RFS) were analyzed.
ResultsThere were significant differences in mRNA and protein expressions of OTUB1 between NSCLC and corresponding non-tumor normal tissues (P < 0.05). There was no correlation in mRNA expression between OTUB1 and PD-L1 in NSCLC tissues (P>0.05), but there was a correlation in protein expression between OTUB1 and PD-L1 (P=0.029). OTUB1 was correlated with TNM staging (P=0.039), but had no correlation with age, history of smoking, degree of differentiation, number of metastatic lymph nodes and pathological type (P>0.05). Kaplan-Meier analysis showed that TNM staging (P < 0.001), the number of metastatic lymph nodes (P=0.001) and the degree of differentiation (P=0.042)were the influencing factors of RFS. The median RFS of negative and positive OTUB1 were 18 months and 19 months, respectively, and there was no significant difference (P>0.05). COX multivariate analysis showed that the degree of differentiation (P=0.005) and TNM staging (P=0.006) were the independent risk factors for RFS.
ConclusionThe mRNA and protein expression levels of OTUB1 in NSCLC tissue are higher than those in corresponding non-tumor normal tissues. In terms of protein level, OTUB1 is positively correlated with PD-L1. OTUB1 expression is related to TNM staging.
-
非小细胞肺癌(NSCLC)的常见病理类型包括腺癌(LUAD)及鳞癌(LUSC)[1]。目前, NSCLC的治疗已经实现了从细胞毒药物阶段、分子靶向治疗阶段向以免疫检查点抑制剂为代表的免疫治疗阶段的显著改变,尤其是免疫治疗进展迅速,在NSCLC、肾癌、霍奇金淋巴瘤等多种肿瘤治疗中均有获益,但总体疗效仍不理想[2]。免疫治疗主要机制包括了程序性死亡受体-1(PD1)及其配体(PD-L1)通路的阻断, PD-L1及PD1为免疫治疗的重要靶点; PD-L1广泛表达于癌细胞、抗原呈递细胞等,与PD1的结合可导致T淋巴细胞功能受损,故PD-L1抑制剂特异性靶向PD-L1蛋白可以避免肿瘤细胞免疫逃逸的发生[3]。PD-L1作为典型的跨膜结构域蛋白,多项研究[4-9]揭示其转运相关的关键调控因子如二甲双胍、趋化素样因子超家族(CMTM)、亨廷顿相互作用蛋白1相关蛋白(HIP1R)、外泌体以及各种翻译后修饰,其中的糖基化、磷酸化、棕榈酰化和泛素化尤其重要。糖基化的PD-L1影响参与泛素化过程酶的磷酸化,阻断了泛素E3连接酶识别PD-L1, 从而影响PD-L1泛素化。PD-L1磷酸化影响其从内质网至高尔基体的转运,缺失磷酸化的PD-L1被内质网相关降解蛋白消除。棕榈酰化通过阻断PD-L1泛素化保持PD-L1的稳定,抑制溶酶体对PD-L1的降解[10]。
卵巢肿瘤泛素异肽酶1(OTUB1)是卵巢肿瘤域蛋白酶去泛素酶家族成员之一,在肿瘤及神经退化等疾病中发挥重要作用,作用机制包括了下调泛素化调节蛋白稳定性等[11]。近期研究[12]发现,OTUB1阻止内质网相关PD-L1降解,明确包括了乳腺癌、肺癌、肾癌及肝癌细胞系等。目前OTUB1在NSCLC组织方面的研究较少,NSCLC中OTUB1是否存在对PD-L1表达的调节有待进一步探索,也能为提高免疫治疗效果提供可选择方案。本研究通过评价肿瘤基因组数据库(TCGA)中NSCLC组织及癌旁正常组织的OTUB1 mRNA差异性,回顾性分析NSCLC组织及癌旁正常组织中OTUB1蛋白差异性。基于基因表达谱数据动态分析(GEPIA)探讨数据库中NSCLC的OTUB1与PD-L1 mRNA相关性,采用免疫组织化学染色(IHC)测定NSCLC组织中OTUB1及PD-L1蛋白表达,探究两者相关性及OTUB1表达与临床特征及对无复发生存期(RFS)的影响,探讨非小细胞肺癌免疫治疗的可能方向,阐明NSCLC可能的发生机制及新的RFS预测因素。
1. 材料与方法
1.1 数据来源
从TCGA数据库Genomic Date Commons Portal(GDC)(https://portal.gdc.cancer.gov) (2021年4月30日)中下载LUAD(n=535)及癌旁正常组织(n=59)和LUSC(n=502)及癌旁正常组织(n=49)的OTUB1表达数据,下载的OTUB1表达数据类型为采用转录组测序技术(RNA-Seq)所获得的HTSeq-FPKM数据[13]; 使用GEPIA数据库分析其数据库下载的NSCLC中OTUB1与PD-L1 mRNA表达相关性[14]。
1.2 组织样本来源
收集2016年6月—2019年12月郑州大学第二附属医院病理确诊为NSCLC并接受了肺癌切除术及淋巴结清扫术的患者的癌组织46例及癌旁正常肺组织蜡块包埋样本41例。纳入标准: 病理确诊为NSCLC、明确的TNM分期、完整的随访记录及临床信息(包括年龄、性别、吸烟史、分化程度及转移淋巴结数等)、至少接受术后标准治疗者。排除标准: 术前接受放化疗、免疫治疗、其他肿瘤病史、死因非肺癌患者。NSCLC者46例,中低分化15例,高分化31例; Ⅰ~Ⅱ期30例, Ⅲ期16例; 年龄29~74岁,有吸烟史26例,无吸烟史20例; 肺鳞癌22例,肺腺癌24例,癌旁正常组织41例。截至2021年5月30日,对所有患者随访,包括门诊随访、入院检查及电话回访。无复发生存期(RFS)指手术至肿瘤复发或者任何原因死亡的时间(以月为单位)。本临床研究方案经郑州大学第二附属医院伦理学委员会批准(伦理批件号2021209)。
1.3 免疫组织化学(IHC)及评分
IHC染色采用的试剂来自单克隆兔抗OTUB1抗体(affbiotech, 编号DF9998)和多克隆兔抗PD-L1抗体(Abcam, 编号ab213524)。实验步骤如下: 石蜡切片脱蜡、水化及修复, 3%H2O2阻断内源性过氧化物酶,加一抗(OTUB1为1∶400, PD-L1为1∶150)后4 ℃过夜; 加二抗孵育, DAB显色、苏木素复染及脱水封片。PD-L1根据肿瘤比例评分(TPS)标准: 即任何染色强度的PD-L1膜染色的肿瘤细胞在所有肿瘤细胞中所占百分比,定义膜染色有0分(< 1%)、1分(1%~ < 50%)、2分(≥50%), 0分为阴性表达组,≥1分为阳性表达组。OTUB1评分标准: 随机选取切片的5个视野(放大倍数400倍),参考抗体说明书,按细胞质中染色强度评分: 即0分(无色)、1分(淡黄色)、2分(棕黄色)、3分(棕褐色); 结合阳性细胞所占百分比,评估为0分(≤5%)、1分(>5%~25%)、2分(>25%~50%)、3分(>50%~75%)和4分(>75%)。OTUB1表达以0~4分为阴性表达, 5~12分为阳性表达。病理切片由郑州大学第二附属医院2位病理医师独立、盲法评分,分析PD-L1、OTUB1的表达。
1.4 统计学分析
采用R软件中“limma”及“beeswarm”包分析来源于TCGA中癌组织与癌旁正常组织中OTUB1表达情况,应用wilcox. test统计分析并描绘散点图。采用SPSS 22.0软件进行统计数据分析,相关性分析采用Sperman等级相关分析,生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验,对有意义的预后因素应用COX回归多因素分析。计数资料采用频数、率表示,比较采用χ2检验。计量资料采用均数±标准差表示,比较采用t检验。检验水准α=0.05, P < 0.05为差异有统计学意义。
2. 结果
2.1 NSCLC组织与癌旁正常组织中OTUB1 mRNA及蛋白表达差异结果
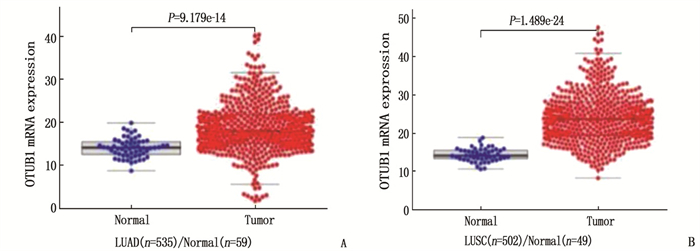
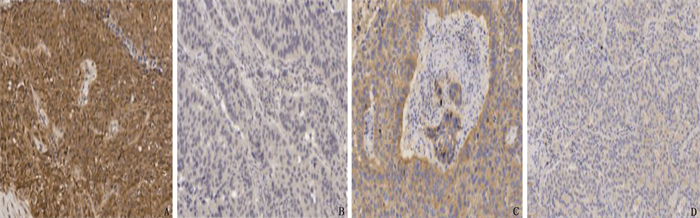
TCGA下载的LUAD(n=535)及癌旁正常组织(n=59)的OTUB1 mRNA比较,差异有统计学意义(P < 0.05); TCGA下载的LUSC(n=502)及癌旁正常组织(n=49)的OTUB1 mRNA比较,差异也有统计学意义(P < 0.05)。见图 1。IHC显示OTUB1主要表达于细胞质中,见图 2。46例肺癌组织中, OTUB1阳性28例(60.9%), 阴性18例(39.1%); 相应的41例癌旁正常组织中, OTUB1阳性15例(36.6%), 阴性26例(63.4%); 肺癌组织与癌旁正常组织的OTUB1表达差异有统计学意义(P < 0.05), 提示NSCLC组织中OTUB1 mRNA及蛋白表达均高于癌旁正常组织。
2.2 NSCLC组织中OUTB1与PD-L1在mRNA、蛋白表达水平的相关性
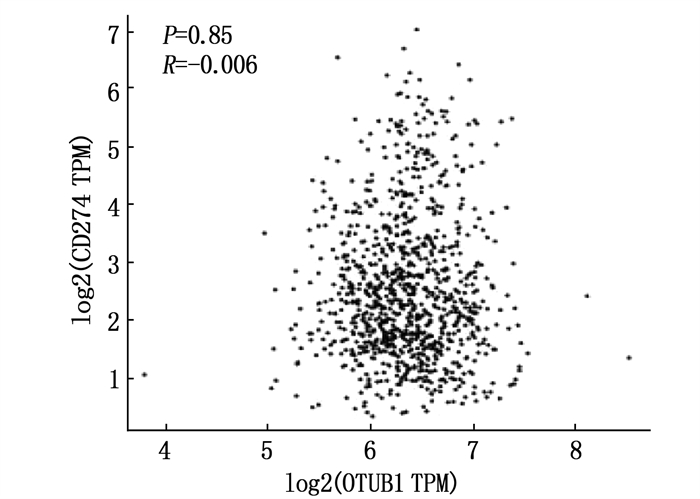
基于GEPIA应用Spearman分析来自其数据库中NSCLC的OTUB1与PD-L1 mRNA水平表达的相关性,结果显示无相关性(r=-0.006, P=0.850), 见图 3。46例肺癌组织中, OTUB1阳性28例(60.9%), 阴性18例(39.1%); PD-L1阳性27例(58.7%), 阴性19例(41.3%); Spearman相关性分析提示两者蛋白水平具有相关性(r=0.323, P=0.029)。
2.3 NSCLC组织中OTUB1表达与各临床特征的关系
不同TNM分期患者OTUB1表达差异具有统计学意义(χ2=4.278, P=0.039), 见表 1。
表 1 NSCLC组织中OTUB1表达与各临床特征的关系临床特征 OTUB1 χ2 P 阴性(n=18) 阳性(n=28) 年龄 < 60岁 6 11 0.167 0.683 ≥60岁 12 17 吸烟史 无 8 12 0.011 0.916 有 10 16 分化程度 高分化 6 9 0.007 0.933 中低分化 12 19 转移淋巴结个数 < 3个 15 18 1.961 0.161 ≥3个 3 10 TNM分期 Ⅰ~Ⅱ期 15 15 4.278 0.039 Ⅲ期 3 13 病理类型 腺癌 11 13 0.947 0.331 鳞癌 7 15 2.4 NSCLC患者术后RFS的影响因素分析
TNM分期(P < 0.001)、转移淋巴结个数(P=0.001)、分化程度(P=0.042)是RFS的影响因素; OTUB1阴性、阳性表达患者的中位RFS分别18、19个月,差异无统计学意义(P>0.05)。见表 2。
表 2 NSCLC患者术后RFS的影响因素分析(Kaplan-Meier法)临床特征 RFS/个月 χ2 P 中位数 95%CI TNM分期 Ⅰ~Ⅱ期 23 10.765~35.235 16.487 <.001 Ⅲ期 10 7.387~12.613 转移淋巴结个数 < 3个 23 17.637~28.363 10.367 0.001 ≥3个 10 7.651~12.349 分化程度 高分化 23 16.098~29.902 4.132 0.042 中低分化 15 10.637~19.363 OTUB1 阴性 18 11.802~24.198 0.323 0.570 阳性 19 10.261~27.739 2.5 NSCLC患者术后RFS影响因素的多因素分析
根据Kaplan-Meier单因素分析结果,以转移淋巴结数、分化程度、TNM分期建立COX多因素风险模型,结果提示分化程度(Hr=3.143, 95%CI为1.407~7.024, P=0.005)及TNM分期(Hr=3.467, 95%CI为1.425~8.435, P=0.006)是影响RFS的独立危险因素,转移淋巴结数不是影响RFS的独立危险因素(Hr=2.267, 95%CI为0.859~5.980, P=0.098)。
3. 讨论
近年来研究[15-16]表明, OTUB1在调控细胞增殖、代谢及代谢相关蛋白方面具有重要作用,并在胃腺癌、结直肠癌及前列腺癌中均发现了OTUB1的高表达。KARUNARATHNA U等[17]证实了OTUB1下调FOXM1泛素水平而促进乳腺癌细胞的增殖能力; IGLESIAS-GATO D等[18]也阐述了OTUB1上调二氢睾酮诱导的前列腺癌细胞株的侵袭力; 但有关肺癌中OTUB1的表达的相关研究却较少。PD-L1作为免疫治疗的主要研究点,除了在遗传、表观遗传、转录及翻译等方面进行研究外,其在蛋白泛素化方面的调控也逐渐成为研究的热点[19]。本研究采用生物信息学与免疫组化实验相结合的方法探讨OTUB1在肺癌组织中的表达及临床意义,发掘可能调控PD-L1的新方向。
相较于OTUB2等其它OTUB1家族成员, OTUB1在泛素链切割方面具有较高的特异性,仅对K48连接多聚泛素链切割,此方式也是OTUB1下调泛素化的经典机制。除此之外, OTUB1通过与携带泛素的E2连接酶结合而阻止泛素向蛋白底物的转移[20-21]。ZHU D等[12]发行BT-549及MDA-MB-231乳腺癌细胞系敲除OTUB1后PD-L1蛋白水平显著降低,且OTUB1的缺失对其影响只限于蛋白水平,其mRNA丰度并未受到影响。其机制可能正是OTUB1发挥了去泛素化酶作用,使PD-L1蛋白保持了较低的泛素化状态,避免其在胞质内被内质网相关降解复合体(ERAD)降解。基于GEPIA分析显示, OTUB1 mRNA及PD-L1 mRNA无明显相关性,一定程度上预测了两者在基因水平上相互调控或者被同一因素调控的可能性较低。本实验采用IHC首次发现了NSCLC组织中OTUB1与PD-L1蛋白呈正相关,佐证了两者可能存在蛋白水平调节的假设,此假设也与乳腺癌中已证实了的OTUB1经下调PD-L1泛素化而避免其被降解的机制相符合。ZHU D等[12]发现NSCLC的A549细胞中OTUB1缺失引起了OTUB1蛋白量下降,与本实验结果一致。
研究[22-25]表明, PD-L1表达水平的升高与肾细胞癌、肺癌、卵巢癌、鼻咽癌等癌症的抗PD-L1疗效及生存预后较差相关。PD-L1作为膜蛋白的一种,大部分均经历了持续的代谢和内化,其释放的动态循环和调控影响了细胞膜上PD-L1的数量,目前的免疫治疗可能只针对暂时暴露于细胞表面的PD-L1[8]。此结果为靶向PD-L1提供了新的调控点,也为增强免疫治疗成效提供了可能性。本研究通过分析来源于TCGA中数据及IHC验证发现了OTUB1较癌旁正常组织表达上调,提示了其在NSCLC发生中可能具有一定的作用。BAIETTI M F等[26]研究发现,在OTUB1下调RAS泛素化激活下游MAPK通路,成为野生RAS型非小细胞肺癌发生的重要机制。LI Y等[27]研究却揭示了OTUB1通过阻断UbcH5降低P53泛素化,从而维持P53稳定性,使得P53在介导细胞凋亡和抑制细胞增殖方面发挥作用。ZHOU Y等[15]研究亦发现了OTUB1阳性表达为肺腺癌早期事件,与本研究Ⅲ期患者中阳性表达率较高不一致,考虑可能与入组病例数较少、纳入标准不同有关。
本研究的局限性: ①本研究存在临床纳入病例数较少的问题,缺乏大规模临床入组。② OTUB1与PD-L1相关性仅局限于人肺腺癌、肺鳞癌病理类型,两者之间mRNA关系仅来自于生物信息学分析。③由于实验条件限制,缺乏肺癌细胞系中OTUB1与PD-L1蛋白水平相关性的验证,即在NSCLC细胞系中敲除OTUB1 mRNA, 行PD-L1 mRNA及蛋白水平检测,在NSCLC中OTUB1调节PD-L1的具体机制尚需进一步研究验证。
综上所述,本研究发现在NSCLC中OTUB1与PD-L1蛋白水平呈正相关,在NSCLC中也呈现高表达,提示OTUB1可能是PD-L1潜在的调节机制中至关重要的一环,也表明其在NSCLC发生中可能发挥一定的作用。
-
表 1 NSCLC组织中OTUB1表达与各临床特征的关系
临床特征 OTUB1 χ2 P 阴性(n=18) 阳性(n=28) 年龄 < 60岁 6 11 0.167 0.683 ≥60岁 12 17 吸烟史 无 8 12 0.011 0.916 有 10 16 分化程度 高分化 6 9 0.007 0.933 中低分化 12 19 转移淋巴结个数 < 3个 15 18 1.961 0.161 ≥3个 3 10 TNM分期 Ⅰ~Ⅱ期 15 15 4.278 0.039 Ⅲ期 3 13 病理类型 腺癌 11 13 0.947 0.331 鳞癌 7 15 表 2 NSCLC患者术后RFS的影响因素分析(Kaplan-Meier法)
临床特征 RFS/个月 χ2 P 中位数 95%CI TNM分期 Ⅰ~Ⅱ期 23 10.765~35.235 16.487 <.001 Ⅲ期 10 7.387~12.613 转移淋巴结个数 < 3个 23 17.637~28.363 10.367 0.001 ≥3个 10 7.651~12.349 分化程度 高分化 23 16.098~29.902 4.132 0.042 中低分化 15 10.637~19.363 OTUB1 阴性 18 11.802~24.198 0.323 0.570 阳性 19 10.261~27.739 -
[1] BARTA J A, POWELL C A, WISNIVESKY J P. Global epidemiology of lung cancer[J]. Ann Glob Heal, 2019, 85(1): 8. doi: 10.5334/aogh.2419
[2] OSMANI L, ASKIN F, GABRIELSON E, et al. Current WHO guidelines and the critical role of immunohistochemical markers in the subclassification of non-small cell lung carcinoma (NSCLC): Moving from targeted therapy to immunotherapy[J]. Semin Cancer Biol, 2018, 52(pt 1): 103-109. http://www.ncbi.nlm.nih.gov/pubmed/29183778
[3] ZOU W, WOLCHOK J D, CHEN L. PD-L1(B7-H1) and PD-1 pathway blockade for cancer therapy: Mechanisms, response biomarkers, and combinations[J]. Sci Transl Med, 2016, 8(328): 328rv4. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4859220/pdf/nihms-780239.pdf
[4] EIKAWA S, NISHIDA M, MIZUKAMI S, et al. Immune-mediated antitumor effect by type 2 diabetes drug, metformin[J]. PNAS, 2015, 112(6): 1809-1814. doi: 10.1073/pnas.1417636112
[5] YANG Y, HSU J M, SUN L, et al. Palmitoylation stabilizes PD-L1 to promote breast tumor growth[J]. Cell Res, 2019, 29(1): 83-86. doi: 10.1038/s41422-018-0124-5
[6] ZHANG J, BU X, WANG H, et al. Cyclin D-CDK4 kinase destabilizes PD-L1 via cullin 3-SPOP to control cancer immune surveillance[J]. Nature, 2018, 553(7686): 91-95. doi: 10.1038/nature25015
[7] LIM S O, LI C W, XIA W, et al. Deubiquitination and stabilization of PD-L1 by CSN5[J]. Cancer Cell, 2016, 30(6): 925-939. doi: 10.1016/j.ccell.2016.10.010
[8] DENG S, ZHOU X, XU J. Checkpoints under traffic control: from and to organelles[J]. Adv Exp Med Biol, 2020, 1248: 431-453. doi: 10.1007/978-981-15-3266-5_18
[9] FRAME S, COHEN P. GSK3 takes centre stage more than 20 years after its discovery[J]. Biochem J, 2001, 359(pt 1): 1-16. http://www.biochemj.org/content/359/1/1.full-text.pdf
[10] YANG Y, HSU J M, SUN L, et al. Palmitoylation stabilizes PD-L1 to promote breast tumor growth[J]. Cell Res, 2019, 29(1): 83-86. doi: 10.1038/s41422-018-0124-5
[11] ZHU Q, FU Y, LI L, et al. The functions and regulation of Otubains in protein homeostasis and diseases[J]. Ageing Res Rev, 2021, 67: 101303. doi: 10.1016/j.arr.2021.101303
[12] ZHU D, XU R, HUANG X, et al. Deubiquitinating enzyme OTUB1 promotes cancer cell immunosuppression via preventing ER-associated degradation of immune checkpoint protein PD-L1[J]. Cell Death Differ, 2021, 28(6): 1773-1789. doi: 10.1038/s41418-020-00700-z
[13] TOMCZAK K, CZERWI? SKA P, WIZNEROWICZ M. The Cancer Genome Atlas (TCGA): an immeasurable source of knowledge[J]. Contemp Oncol: Pozn, 2015, 19(1a): A68-A77. http://www.scienceopen.com/document_file/ac4bb8d0-842c-4c65-924e-c0b532b5ab9c/PubMedCentral/ac4bb8d0-842c-4c65-924e-c0b532b5ab9c.pdf
[14] TANG Z, LI C, KANG B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(w1): W98-W102. doi: 10.1093/nar/gkx247
[15] ZHOU Y, WU J, FU X, et al. OTUB1 promotes metastasis and serves as a marker of poor prognosis in colorectal cancer[J]. Mol Cancer, 2014, 13: 258. doi: 10.1186/1476-4598-13-258
[16] WENG W, ZHANG Q, XU M, et al. OTUB1 promotes tumor invasion and predicts a poor prognosis in gastric adenocarcinoma[J]. Am J Transl Res, 2016, 8(5): 2234-2244. http://ajtr.org/files/ajtr0023747.pdf
[17] KARUNARATHNA U, KONGSEMA M, ZONA S, et al. OTUB1 inhibits the ubiquitination and degradation of FOXM1 in breast cancer and epirubicin resistance[J]. Oncogene, 2016, 35(11): 1433-1444. doi: 10.1038/onc.2015.208
[18] IGLESIAS-GATO D, CHUAN Y C, JIANG N, et al. Erratum: OTUB1 de-ubiquitinating enzyme promotes prostate cancer cell invasion in vitro and tumorigenesis in vivo[J]. Mol Cancer, 2015, 14: 88. doi: 10.1186/s12943-015-0341-1
[19] WANG Y, WANG H, YAO H, et al. Regulation of PD-L1: emerging routes for targeting tumor immune evasion[J]. Front Pharmacol, 2018, 9: 536. doi: 10.3389/fphar.2018.00536
[20] ALTUN M, WALTER T S, KRAMER H B, et al. The human otubain2-ubiquitin structure provides insights into the cleavage specificity of poly-ubiquitin-linkages[J]. PLoS One, 2015, 10(1): e0115344. doi: 10.1371/journal.pone.0115344
[21] WIENER R, ZHANG X, WANG T, et al. The mechanism of OTUB1-mediated inhibition of ubiquitination[J]. Nature, 2012, 483(7391): 618-622. doi: 10.1038/nature10911
[22] FEDCHENKO N, REIFENRATH J. Different approaches for interpretation and reporting of immunohistochemistry analysis results in the bone tissue-a review[J]. Diagn Pathol, 2014, 9: 221. doi: 10.1186/s13000-014-0221-9
[23] THOMPSON R H, KUNTZ S M, LEIBOVICH B C, et al. Tumor B7-H1 is associated with poor prognosis in renal cell carcinoma patients with long-term follow-up[J]. Cancer Res, 2006, 66(7): 3381-3385. doi: 10.1158/0008-5472.CAN-05-4303
[24] HSU M C, HSIAO J R, CHANG K C, et al. Increase of programmed death-1-expressing intratumoral CD8 T cells predicts a poor prognosis for nasopharyngeal carcinoma[J]. Mod Pathol, 2010, 23(10): 1393-1403. doi: 10.1038/modpathol.2010.130
[25] HAMANISHI J, MANDAI M, IWASAKI M, et al. Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer[J]. PNAS, 2007, 104(9): 3360-3365. doi: 10.1073/pnas.0611533104
[26] BAIETTI M F, SIMICEK M, ABBASI ASBAGH L, et al. OTUB1 triggers lung cancer development by inhibiting RAS monoubiquitination[J]. EMBO Mol Med, 2016, 8(3): 288-303. doi: 10.15252/emmm.201505972
[27] LI Y, SUN X X, ELFERICH J, et al. Monoubiquitination is critical for ovarian tumor domain-containing ubiquitin aldehyde binding protein 1(Otub1) to suppress UbcH5 enzyme and stabilize p53 protein[J]. J Biol Chem, 2014, 289(8): 5097-5108. doi: 10.1074/jbc.M113.533109
-
期刊类型引用(2)
1. 孔令玉,朱天怡. 微小RNA-1180在非小细胞肺癌中的表达及其临床意义. 实用临床医药杂志. 2022(03): 76-80 .  本站查看
本站查看
2. 朱洪宇,史志敏. 微小RNA-338-3p调控信号转导和转录激活因子1对表皮生长因子受体酪氨酸激酶抑制剂耐药肺癌细胞株PC-9/GR中程序性死亡配体1表达和细胞凋亡的影响. 实用临床医药杂志. 2022(04): 100-105 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
