Correlations of highly-expressed purinergic ligand-gated ion channel 7 purine receptor with clinicopathological features and prognosis in patients with resectable non-small cell lung cancer
-
摘要:目的
分析嘌呤能型2受体家族X7嘌呤受体(P2X7R)表达与可切除非小细胞肺癌(NSCLC)患者临床病理特征及预后的关系。
方法选取120例NSCLC患者肿瘤组织标本, 其中67例组织标本包含癌旁正常肺组织。分析P2X7R表达情况与临床病理特征的相关性; 采用Logistic回归模型和Kaplan-Meier生存曲线评估P2X7R表达情况对NSCLC患者生存预后的预测价值。
结果NSCLC组织中P2X7R阳性表达率高于癌旁正常组织, 差异有统计学意义(P < 0.01);TNM分期Ⅲ期、淋巴结状态N1或N2期、肿瘤直径≥3 cm及CD8+肿瘤浸润性淋巴细胞(TILs)低密度的NSCLC患者的P2X7R高表达率更高, 差异有统计学意义(P < 0.05或P < 0.01);P2X7R低表达者5年无病生存率和总生存率均高于P2X7R高表达者, 差异有统计学意义(P < 0.01)。Cox回归分析显示, NSCLC组织P2X7R表达是5年无病生存率和总生存率的独立预后影响因子(P < 0.05)。NSCLC组织中P2X7R表达预测5年复发或转移、总生存期的受试者工作特征曲线的曲线下面积分别为0.850(95%CI: 0.770~0.930)、0.780(95%CI: 0.696~0.864)。
结论P2X7R可作为NSCLC可靠的预后指标和潜在的治疗靶点。
-
关键词:
- 嘌呤能型2受体家族X7嘌呤受体 /
- 非小细胞肺癌 /
- 临床病理特征 /
- 总生存期 /
- 无病生存率
Abstract:ObjectiveTo analyze the correlations of highly-expressed purinergic ligand-gated ion channel 7 purine receptor (P2X7R) with clinicopathological features and prognosis in patients with resectable non-small cell lung cancer (NSCLC).
MethodsA total of 120 specimens of tumor tissue were selected in patients with NSCLC, of which 67 tissue specimens contained adjacent normal lung tissues.The correlation between P2X7R expression and clinicopathological features was analyzed; the Logistic regression model and Kaplan-Meier survival curve were used to evaluate the value of P2X7R expression in predicting the survival and prognosis of NSCLC patients.
ResultsThe positive expression rate of P2X7R in the NSCLC tissues was significantly higher than that in adjacent normal tissues (P < 0.01);the high expression rate of P2X7R was significantly higher in the NSCLC patients with phase Ⅲ of TNM staging, phase N1 or N2 of lymph node status, tumor diameter≥3 cm and low density of CD8+ tumour-infiltrating lymphocytes (TILs)(P < 0.05 or P < 0.01);the 5-year disease-free survival and overall survival of patients with low expression of P2X7R were significantly higher than those with high expression of P2X7R (P < 0.01).Cox regression analysis showed that the expression of P2X7R in NSCLC tissues was an independent prognostic influencing factor for 5-year disease-free survival and overall survival (P < 0.05).The areas under the curve of the receiver operating characteristic curve of P2X7R expression in NSCLC tissues for prediction of 5-year recurrence or metastasis and overall survival were 0.850(95%CI, 0.770 to 0.930) and 0.780(95%CI, 0.696 to 0.864) respectively.
ConclusionP2X7R can be used as a reliable prognostic index and potential therapeutic target for NSCLC.
-
肺癌是全球癌症死亡的主要原因之一,约占所有癌症死亡人数的1/5, 其中非小细胞肺癌(NSCLC)是最常见的病理类型[1]。由于缺乏典型的临床症状及有效的早期筛查程序, NSCLC患者的5年相对生存率仅为19%[1-3]。因此,寻找简单、灵敏、高效的生物标志物具有重要的临床意义。三磷酸腺苷(ATP)除了作为细胞内的能量分子,还参与了细胞间信号转导,其相关受体被称为嘌呤能型2受体家族受体(P2Rs), 由P2XR和P2YR这2个亚家族组成。P2XR是一类配体门控离子通道,由7个不同亚型组成,其中P2X7受体(P2X7R)定位于细胞膜,具有独特而重要的生物学功能,被认为是肿瘤侵袭和转移的重要介质,在炎症和有氧糖酵解中发挥重要作用[4]。因此, P2X7R可能是多种癌症的新的生物标志物,也可能是靶向治疗的新选择[5]。本研究探讨肿瘤组织P2X7R高表达对可切除NSCLC患者生存预后的影响,现报告如下。
1. 资料与方法
1.1 一般资料
选取2010—2015年在本院接受肺叶切除或全肺切除术的NSCLC患者120例,平均年龄(56.03±15.00)岁,收集所有患者术中肿瘤标本,其中67例组织标本包括了癌旁正常肺组织(距离手术切缘≥5 cm)。经本院电子数据中心获取患者的临床资料。纳入标准: ①经组织病理学或细胞学诊断为NSCLC者; ②由2位病理学家分别从肿瘤定位、组织病理类型、组织学分级、TNM分期等方面对患者病理资料进行了评估; ③接受根治性手术和肺门纵隔淋巴结清扫,且术后接受辅助放疗者; ④排除术前接受新辅助化疗者。组织学检查和肿瘤细胞分化的分级依据世界卫生组织2004年修订的分类方案和国际抗癌联盟(UICC)的2009年TNM分期系统进行; 患者生存数据是从医院的医疗数据处理记录中收集的; 将手术日期至死亡日期的间隔时间确定为总生存期(OS)。本研究经本院伦理委员会批准,获得所有患者的书面知情同意,并按照机构指南的规定采集组织样本。
1.2 免疫组化法(IHC)检测组织P2X7R表达
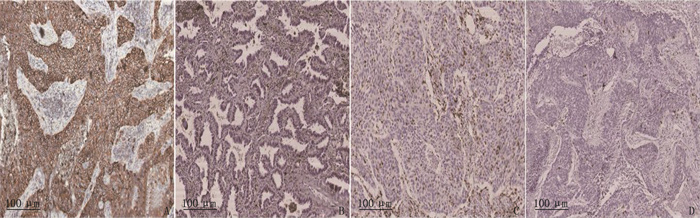
将使用福尔马林固定、石蜡包埋的病理组织制成5 μm切片,在60 ℃恒温箱内加热1 h, 然后进行IHC分析。使用二甲苯脱蜡,并在梯度乙醇中再水化,在室温下于含3% H2O2的甲醇溶液中孵育30 min, 消除内源性过氧化物酶活性; 将组织切片于98 ℃下在pH值为9.0的目标修复溶液(Dako, 丹麦)中孵育40 min; 采用磷酸盐缓冲溶液(PBS)(Dako, 丹麦)洗涤数次后,将组织切片与抗P2X7抗体(ABCAM, 英国, 1∶ 100)或抗CD8抗体(ABCAM, 英国, 1∶ 250)在4 ℃下孵育过夜。与一抗孵育后,将切片组织在PBS中冲洗2次,并在室温下与Dako Envision System HRP偶联兔抗体孵育30 min; 在PBS中洗涤组织切片,与3, 3′-二氨基联苯胺四盐酸盐(DAB)(Dako, 丹麦)在室温下孵育6~10 min显色以用于蛋白质检测,并用苏木素复染1 min。采用ICH检测P2X7R在肿瘤细胞中的表达强度和分布; 采用CD8染色法评估肿瘤浸润性淋巴细胞(TILs)密度。每个样本的免疫染色由2位病理学专家独立审阅。
1.3 IHC结果判断标准
P2X7R的表达通过IHC评分进行评估,该评分是将胞浆和胞膜染色强度(0分为阴性, 1分为弱染色, 2分为中等染色, 3分为强染色)乘以染色程度(< 10%为0分, 10%~ < 25%为1分, 25%~70%为2分, >70%为3分)。IHC评分范围为0~9分,根据既往研究[6]数据,将3分作为最佳临界值, < 3分是低P2X7R组, ≥3分是高P2X7R组。评估CD8+ TILs的密度: 随机选择5个视野,首先进行半定量染色评分,分为1分(< 1%)、2分(1%~ < 10%)、3分(10%~ < 33%)、4分(33%~66%)、5分(>66%); 免疫反应阳性的细胞表现为胞浆和(或)质膜部分或全部阳性; 染色密度分别为缺失、轻(+)、中(++)、强(+++); 计算得分(1~8分),按CD8+ TILs密度的平均值分为低密度组和高密度组。
1.4 随访预后情况
所有NSCLC患者术后每半年随访1次,随访需进行胸部增强CT,并根据需要进行腹部、头部等部位检查。自手术后次日开始,记录肿瘤复发或转移的部位及时间,随访日期截至2021年10月31日。
1.5 统计学分析
采用SPSS 24.0软件进行统计学分析。采用卡方检验分析NSCLC与癌旁正常肺组织P2X7R表达的差异,并采用卡方检验分析P2X7R表达与NSCLC临床病理特征的关系。生存率采用Kaplan-Meier分析,生存率曲线的比较采用Log-rank检验。采用单因素和多因素Cox回归模型分析影响NSCLC患者预后的因素。绘制受试者工作特征(ROC)曲线,分析P2X7R表达诊断NSCLC及预测预后不良的曲线下面积(AUC)。P < 0.05(双侧)为差异有统计学意义。
2. 结果
2.1 P2X7R的表达水平及其与临床病理特征的关系
NSCLC组织中P2X7R阳性表达率为51.67% (62/120), 高于癌旁正常组织中的25.37%(17/67), 差异有统计学意义(P < 0.01)。见图 1。在P2X7R表达与临床病理特征的分析中, TNM分期Ⅲ期、淋巴结状态N1或N2期、肿瘤直径≥3 cm及CD8+ TILs低密度的NSCLC患者的P2X7R高表达率更高,差异有统计学意义(P < 0.05或P < 0.01)。见表 1。
表 1 NSCLC组织中P2X7R表达与临床病理特征的关系[n(%)]指标 分类 n P2X7R表达 χ2 P 低表达(n=57) 高表达(n=63) 年龄 < 60岁 67 34(50.75) 33(49.25) 0.641 0.423 ≥60岁 53 23(43.40) 30(56.60) 性别 男 88 44(50.00) 44(50.00) 0.827 0.363 女 32 13(40.63) 19(59.38) TNM分期 Ⅰ~Ⅱ期 91 51(56.04) 40(43.96) 11.021 < 0.001 Ⅲ期 29 6(20.69) 23(79.31) 淋巴结状态 N0期 60 37(61.67) 23(38.33) 9.657 0.002 N1或N2期 60 20(33.33) 40(66.67) 分化程度 低或未分化 32 12(37.50) 20(62.50) 1.895 0.388 中 57 30(52.63) 27(47.37) 高 31 15(48.39) 16(51.61) 吸烟史 是 36 21(58.33) 15(41.67) 2.420 0.120 否 84 36(42.86) 48(57.14) 肿瘤直径 < 3 cm 51 31(60.78) 20(39.22) 6.277 0.012 ≥3 cm 69 26(37.68) 43(62.32) 病理类型 鳞癌 70 37(52.86) 33(47.14) 1.933 0.390 腺癌 50 20(40.00) 30(60.00) CD8+ TILs密度 低 88 27(30.68) 61(69.32) 37.431 < 0.001 高 32 30(93.75) 2(6.25) P2X7R: 2型嘌呤能受体家族嘌呤能离子通道型7受体; TILs: 肿瘤浸润性淋巴细胞。 2.2 生存曲线分析
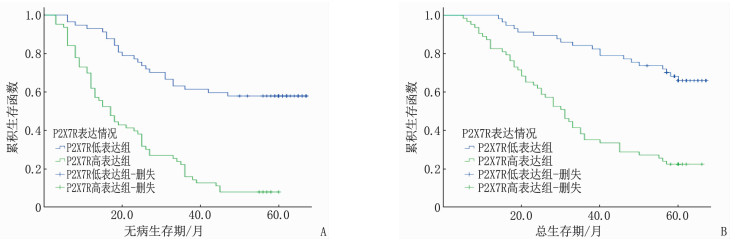
随访期内复发82例(68.33%),包括局部复发18例,远处转移52例,局部复发和远处转移12例。患者5年总生存率为43.33%(52/120)。经Kaplan-Meier生存曲线和Log-rank检验显示, P2X7R低表达者5年无病生存率(57.89%对比7.94%)和总生存率(66.67%对比22.22%)更高,差异有统计学意义(P < 0.01), 见图 2。
2.3 预后影响因素的单因素和多因素分析
经单因素分析,肿瘤直径、NSCLC组织CD8+ TILs密度及NSCLC组织P2X7R表达均是NSCLC患者5年无病生存率的预后影响因子(P < 0.05), 而吸烟史、TNM分期、淋巴结状态、NSCLC组织CD8+ TILs密度及NSCLC组织P2X7R表达均是NSCLC患者5年总生存率的预后影响因子(P < 0.05), 见表 2。多因素Cox回归分析显示, TNM分期、吸烟史是患者总生存率的独立预后影响因子,而NSCLC组织中P2X7R表达是影响5年无病生存率和总生存率的独立预后影响因子(P < 0.05)。见表 3。
表 2 单因素分析影响NSCLC患者预后不良的预后因素变量 无病生存 总生存 OR(95%CI) P OR(95%CI) P 年龄 1.017(0.991~1.044) 0.205 1.009(0.985~1.034) 0.458 性别 0.404(0.150~1.085) 0.072 0.600(0.259~1.393) 0.235 吸烟史 0.629(0.277~1.428) 0.267 0.418(0.188~0.927) 0.032 组织学类型 0.832(0.383~1.809) 0.643 1.098(0.527~2.285) 0.803 组织分化程度 1.049(0.745~1.477) 0.786 1.199(0.868~1.658) 0.271 TNM分期 1.482(0.869~2.528) 0.149 4.136(2.230~7.673) < 0.001 淋巴结状态 1.362(0.629~2.949) 0.433 3.541(1.655~7.578) 0.001 肿瘤直径 2.957(1.336~6.546) 0.007 1.980(0.947~4.138) 0.069 癌旁正常组织P2X7R表达 0.954(0.630~1.445) 0.824 1.053(0.713~1.555) 0.796 NSCLC组织CD8+ TILs密度 3.616(1.546~8.459) 0.003 5.199(2.136~12.656) < 0.001 NSCLC组织P2X7R表达 15.048(5.258~43.069) < 0.001 7.737(3.403~17.590) < 0.001 联合化疗 1.046(0.470~2.328) 0.913 0.574(0.232~1.424) 0.231 NSCLC: 非小细胞肺癌; P2X7R: 2型嘌呤能受体家族嘌呤能离子通道型7受体; TILs: 肿瘤浸润性淋巴细胞。 表 3 多因素分析NSCLC患者预后不良的影响因素变量 无病生存 总生存 OR(95%CI) P OR(95%CI) P 吸烟史 — — 0.342(0.128~0.915) 0.033 TNM分期 — — 2.999(1.308~6.878) 0.010 淋巴结状态 — — 1.564(0.505~4.844) 0.438 肿瘤直径 2.242(0.890~5.644) 0.087 — — NSCLC组织CD8+ TILs密度 0.893(0.309~2.581) 0.893 2.246(0.647~7.800) 0.203 NSCLC组织P2X7R表达 14.486(4.350~48.241) < 0.001 3.094(1.065~8.987) 0.038 NSCLC: 非小细胞肺癌; P2X7R: 2型嘌呤能受体家族嘌呤能离子通道型7受体; TILs: 肿瘤浸润性淋巴细胞。 2.4 P2X7R表达预测NSCLC患者预后不良的效能
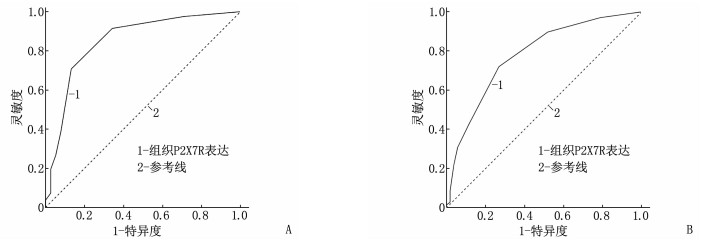
经ROC曲线分析, NSCLC组织P2X7R表达预测NSCLC患者5年复发或转移、总生存期的AUC分别为0.850(95%CI: 0.770~0.930)、0.780(95%CI: 0.696~0.864), cut-off值均为2.5分,特异度分别为70.7%、73.1%, 灵敏度分别为86.8%、72.1%。见图 3。
3. 讨论
肺癌是癌症死亡的主要原因,约占癌症死亡总数的19%, 肺癌早期缺乏典型症状,大多数患者确诊时已属晚期,故很难达到有效治疗。局部肺癌的5年生存率为53.2%, 但在晚期和发生转移后的生存率仅有23.7%和3.5%。因此,肺癌的早期诊断对降低患者病死率至关重要[7-10]。本研究发现NSCLC组织中的P2X7R表达显著高于癌旁正常组织,且通过多因素Cox回归模型和ROC曲线分析发现, P2X7R表达是影响5年无病生存率和总生存率的独立预后影响因子, NSCLC组织中P2X7R阳性表达对患者预后不良有一定的预测效能,提示P2X7R可能参与了NSCLC的发生、发展。
P2X7R是嘌呤受体的亚型,其被发现可作为多种疾病的治疗靶标。P2X7R已被证实在调节炎症反应中发挥重要作用,几乎所有炎症细胞类型中都有表达,包括淋巴细胞、巨噬细胞、树突状细胞、单核细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞和肥大细胞,以促进适应性免疫和先天免疫。健康组织中细胞外ATP的含量很低,在发生组织损伤、炎症、缺氧、缺血以及肿瘤微环境中会显著增加,这种核苷酸通过作用于P2受体来影响癌症和浸润性免疫细胞反应,而定位于胞质膜的P2X7R被认为是肿瘤侵袭及转移的重要介质,在炎症和有氧糖酵解过程中发挥重要作用[11-14]。DE MARCHI E等[15]发现P2X7R过表达与白血病微环境中ATP水平、急性髓系白血病及对化疗的反应有相关性,并且认为P2X7及其遗传变异体可以被视为血液系统恶性肿瘤的潜在的新的生物标志物以及新的治疗靶点。ZHANG Y C等[16]研究表明, P2X7激活促进PI3K/Akt/GSK3β/β-catenin和mTOR/HIF1α/VEGF信号传导,从而介导骨肉瘤细胞的促肿瘤作用,并且P2X7激动剂全身给药诱导了骨肉瘤裸鼠的肿瘤生长、转移和肿瘤相关的骨破坏,而P2X7拮抗剂则逆转了这些作用。CALIK I等[6]还发现P2X7R过表达是胃癌患者预后不良的独立影响因素, P2X7R高表达与胃癌患者的晚期TNM分期及转移有关。本研究也发现TNM分期III期、淋巴结转移、肿瘤直径≥3 cm及CD8+ TILs低密度的NSCLC患者的P2X7R高表达率显著更高。研究[17]证实NSCLC患者组织中CD8+ TILs高密度是有利于患者预后的标志物,表明P2X7R可能参与NSCLC疾病的进展,并可能与患者不良预后相关。
研究[18]对P2X7 mRNA与NSCLC的相关性进行了探讨,发现与表现出P2X7 mRNA高表达的样品相比, P2X7 mRNA低表达的样品表现出更高的miR-21表达量, K-Ras突变型NSCLC患者的肿瘤样本中观察到显著升高的miR-21表达,这些过程可能与肿瘤进展相关; 此外,与P2X7 mRNA低表达患者相比,高表达NSCLC患者的无进展生存期和总生存期显著更低。本研究中, P2X7R低表达者5年无病生存率和总生存率更高。吴丹等[19]认为P2X7R高表达导致NSCLC临床预后不佳的机制可能为: P2X7R高表达可诱导癌细胞侵袭和转移; P2X7R可能通过影响上皮间质转化而影响NSCLC的进展; P2X7R高表达可促进癌细胞中新生血管形成。QIN J L等[20]研究发现P2X7在巨噬细胞中高表达,并且P2X7缺乏可通过在体内和体外下调信号转导及转录激活蛋白6(STAT6)和干扰素调节因子4(IRF4)磷酸化来削弱巨噬细胞的“M2样”极化, P2X7缺乏可通过降低肿瘤细胞增殖和血管生成、促进T细胞动员和逆转M2样巨噬细胞极化来限制乌拉坦诱导的肺癌发生和Lewis肺癌的进展; 通过P2X7抑制剂及O-ATP、A-438079盐酸盐和A-740003共同给药,克服了对免疫疗法[抗程序性死亡受体1(PD-1)抗体]和化学疗法(顺铂)的耐药性,证明了P2X7可能成为治疗NSCLC的新靶点[21-22]。
综上所述, NSCLC组织中P2X7R高表达是NSCLC患者预后不良的独立预测指标,并且与TNM III期、淋巴结转移、肿瘤生长有关。P2X7R蛋白表达与CD8+ TILs肿瘤组织浸润的负相关性亦揭示了其在调节肿瘤微环境中的重要作用,这些发现均支持P2XR7可能是理想的NSCLC预测因子和生物分子靶点。
-
表 1 NSCLC组织中P2X7R表达与临床病理特征的关系[n(%)]
指标 分类 n P2X7R表达 χ2 P 低表达(n=57) 高表达(n=63) 年龄 < 60岁 67 34(50.75) 33(49.25) 0.641 0.423 ≥60岁 53 23(43.40) 30(56.60) 性别 男 88 44(50.00) 44(50.00) 0.827 0.363 女 32 13(40.63) 19(59.38) TNM分期 Ⅰ~Ⅱ期 91 51(56.04) 40(43.96) 11.021 < 0.001 Ⅲ期 29 6(20.69) 23(79.31) 淋巴结状态 N0期 60 37(61.67) 23(38.33) 9.657 0.002 N1或N2期 60 20(33.33) 40(66.67) 分化程度 低或未分化 32 12(37.50) 20(62.50) 1.895 0.388 中 57 30(52.63) 27(47.37) 高 31 15(48.39) 16(51.61) 吸烟史 是 36 21(58.33) 15(41.67) 2.420 0.120 否 84 36(42.86) 48(57.14) 肿瘤直径 < 3 cm 51 31(60.78) 20(39.22) 6.277 0.012 ≥3 cm 69 26(37.68) 43(62.32) 病理类型 鳞癌 70 37(52.86) 33(47.14) 1.933 0.390 腺癌 50 20(40.00) 30(60.00) CD8+ TILs密度 低 88 27(30.68) 61(69.32) 37.431 < 0.001 高 32 30(93.75) 2(6.25) P2X7R: 2型嘌呤能受体家族嘌呤能离子通道型7受体; TILs: 肿瘤浸润性淋巴细胞。 表 2 单因素分析影响NSCLC患者预后不良的预后因素
变量 无病生存 总生存 OR(95%CI) P OR(95%CI) P 年龄 1.017(0.991~1.044) 0.205 1.009(0.985~1.034) 0.458 性别 0.404(0.150~1.085) 0.072 0.600(0.259~1.393) 0.235 吸烟史 0.629(0.277~1.428) 0.267 0.418(0.188~0.927) 0.032 组织学类型 0.832(0.383~1.809) 0.643 1.098(0.527~2.285) 0.803 组织分化程度 1.049(0.745~1.477) 0.786 1.199(0.868~1.658) 0.271 TNM分期 1.482(0.869~2.528) 0.149 4.136(2.230~7.673) < 0.001 淋巴结状态 1.362(0.629~2.949) 0.433 3.541(1.655~7.578) 0.001 肿瘤直径 2.957(1.336~6.546) 0.007 1.980(0.947~4.138) 0.069 癌旁正常组织P2X7R表达 0.954(0.630~1.445) 0.824 1.053(0.713~1.555) 0.796 NSCLC组织CD8+ TILs密度 3.616(1.546~8.459) 0.003 5.199(2.136~12.656) < 0.001 NSCLC组织P2X7R表达 15.048(5.258~43.069) < 0.001 7.737(3.403~17.590) < 0.001 联合化疗 1.046(0.470~2.328) 0.913 0.574(0.232~1.424) 0.231 NSCLC: 非小细胞肺癌; P2X7R: 2型嘌呤能受体家族嘌呤能离子通道型7受体; TILs: 肿瘤浸润性淋巴细胞。 表 3 多因素分析NSCLC患者预后不良的影响因素
变量 无病生存 总生存 OR(95%CI) P OR(95%CI) P 吸烟史 — — 0.342(0.128~0.915) 0.033 TNM分期 — — 2.999(1.308~6.878) 0.010 淋巴结状态 — — 1.564(0.505~4.844) 0.438 肿瘤直径 2.242(0.890~5.644) 0.087 — — NSCLC组织CD8+ TILs密度 0.893(0.309~2.581) 0.893 2.246(0.647~7.800) 0.203 NSCLC组织P2X7R表达 14.486(4.350~48.241) < 0.001 3.094(1.065~8.987) 0.038 NSCLC: 非小细胞肺癌; P2X7R: 2型嘌呤能受体家族嘌呤能离子通道型7受体; TILs: 肿瘤浸润性淋巴细胞。 -
[1] SUN L, ZHOU H B, YANG Y, et al. Meta-analysis of diagnostic and prognostic value of miR-126 in non-small cell lung cancer[J]. Biosci Rep, 2020, 40(5): BSR20200349. doi: 10.1042/BSR20200349
[2] DING H, WEN W, DING Q Q, et al. Diagnostic valuation of serum miR-184 and miR-191 in patients with non-small-cell lung cancer[J]. Cancer Control, 2020, 27(1): 1073274820964783.
[3] YE Q, ZHANG M, YIN Y P. Katanin P80 correlates with larger tumor size, lymph node metastasis, and advanced TNM stage and predicts poor prognosis in non-small-cell lung cancer patients[J]. J Clin Lab Anal, 2020, 34(4): e23141.
[4] 李倩倩, 朱晓娣, 赵荣兰, 等. P2X7受体在结肠癌进展中的作用[J]. 国际肿瘤学杂志, 2021, 48(4): 250-253. doi: 10.3760/cma.j.cn371439-20200903-00050 [5] 朱晓娣, 李倩倩, 赵荣兰, 等. P2X7受体与胰腺癌关系的研究进展[J]. 医学研究生学报, 2020, 33(3): 307-311. https://www.cnki.com.cn/Article/CJFDTOTAL-JLYB202003018.htm [6] CALIK I, CALIK M, SARIKAYA B, et al. P2X7 receptor as an independent prognostic indicator in gastric cancer[J]. Bosn J Basic Med Sci, 2020, 20(2): 188-196.
[7] GOEBEL C, LOUDEN C L, MCKENNA R Jr, et al. Diagnosis of non-small cell lung cancer for early stage asymptomatic patients[J]. Cancer Genomics Proteomics, 2019, 16(4): 229-244. doi: 10.21873/cgp.20128
[8] 闫飞, 马艳宁, 宋燕, 等. 多个肿瘤标志物联合检测诊断非小细胞肺癌的价值[J]. 实用临床医药杂志, 2021, 25(9): 14-17. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL202109004.htm [9] 吕华伟, 严春霞, 沈冬明. 4种肿瘤标志物联合检测诊断肺癌的价值分析[J]. 实用临床医药杂志, 2020, 24(14): 45-47, 52. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL202014012.htm [10] DU Q, LI E C, LIU Y E, et al. CTAPⅢ/CXCL7: a novel biomarker for early diagnosis of lung cancer[J]. Cancer Med, 2018, 7(2): 325-335. doi: 10.1002/cam4.1292
[11] DI V F. P2X7 is a cytotoxic receptor receptor… maybe not: implications for cancer[J]. Purinergic Signal, 2021, 17(1): 55-61. doi: 10.1007/s11302-020-09735-w
[12] GIANNUZZO A, PEDERSEN S F, NOVAK I. The P2X7 receptor regulates cell survival, migration and invasion of pancreatic ductal adenocarcinoma cells[J]. Mol Cancer, 2015, 14: 203. doi: 10.1186/s12943-015-0472-4
[13] 谢玉霜, 包永芬, 陶喆, 等. P2X7受体与疾病的相关性[J]. 生命的化学, 2020, 40(1): 57-63. https://www.cnki.com.cn/Article/CJFDTOTAL-SMHX202001010.htm [14] 陈永和, 苏宝倡, 尚孟乔. P2X7受体在类风湿关节炎中的诊断价值及炎症反应中的作用[J]. 南方医科大学学报, 2018, 38(12): 1453-1458. https://www.cnki.com.cn/Article/CJFDTOTAL-DYJD201812010.htm [15] DE MARCHI E, PEGORARO A, ADINOLFI E. P2X7 receptor in hematological malignancies[J]. Front Cell Dev Biol, 2021, 9: 645605. doi: 10.3389/fcell.2021.645605
[16] ZHANG Y C, CHENG H, LI W K, et al. Highly-expressed P2X7 receptor promotes growth and metastasis of human HOS/MNNG osteosarcoma cells via PI3K/Akt/GSK3β/β-catenin and mTOR/HIF1α/VEGF signaling[J]. Int J Cancer, 2019, 145(4): 1068-1082. doi: 10.1002/ijc.32207
[17] CHEN B C, LI H, LIU C, et al. Prognostic value of the common tumour-infiltrating lymphocyte subtypes for patients with non-small cell lung cancer: a meta-analysis[J]. PLoS One, 2020, 15(11): e0242173. doi: 10.1371/journal.pone.0242173
[18] BOLDRINI L, GIORDANO M, AL G, et al. P2X7 mRNA expression in non-small cell lung cancer: microRNA regulation and prognostic value[J]. Oncol Lett, 2015, 9(1): 449-453. doi: 10.3892/ol.2014.2620
[19] 吴丹, 耿爽, 胡轶. P2X7受体在非小细胞肺癌中的表达及其临床意义[J]. 中国现代医学杂志, 2020, 30(22): 19-24. doi: 10.3969/j.issn.1005-8982.2020.22.004 [20] QIN J L, ZHANG X Y, TAN B H, et al. Blocking P2X7-mediated macrophage polarization overcomes treatment resistance in lung cancer[J]. Cancer Immunol Res, 2020, 8(11): 1426-1439.
[21] SALAHUDDIN M M, OMRAN G A, HELMY M W, et al. Effect of regorafenib on P2X7 receptor expression and different oncogenic signaling pathways in a human breast cancer cell line: a potential of new insight of the antitumor effects of regorafenib[J]. Curr Issues Mol Biol, 2021, 43(3): 2199-2209. doi: 10.3390/cimb43030154
[22] YIN C C, SHEN W H, ZHANG M M, et al. Inhibitory effects of palmatine on P2X7 receptor expression in trigeminal ganglion and facial pain in trigeminal neuralgia rats[J]. Front Cell Neurosci, 2021, 15: 672022. doi: 10.3389/fncel.2021.672022
-
期刊类型引用(1)
1. 郑钧麒,刘相燕. 肺癌化疗后肺部感染病原菌的分布及血清细胞角蛋白19片段抗原、高迁移率族蛋白B1及可溶性血红蛋白清道夫受体的诊断价值. 实用临床医药杂志. 2024(14): 7-11 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号