Correlations of CALLY index in early pregnancy with the onset and severity of preeclampsia
-
摘要:目的
探讨妊娠早期CALLY指数与子痫前期发病及其严重程度的相关性。
方法前瞻性选取987例孕妇作为研究对象, 42例在随访过程中失访, 最终纳入945例。依据随访过程中是否发生子痫前期及其严重程度,将孕妇分为子痫前期组47例、重度子痫前期组49例和正常组849例。收集所有孕妇的一般资料和实验室检查结果,并计算CALLY指数。采用Pearson相关性分析法探讨CALLY指数与子痫前期病情严重程度(平均动脉压)的相关性; 绘制受试者工作特征(ROC)曲线,分析各指标对子痫前期的预测效能; 采用Cox回归分析探讨子痫前期发生的影响因素。
结果重度子痫前期组孕妇的平均动脉压、24 h尿蛋白水平高于子痫前期组和正常组,且子痫前期组高于正常组,差异有统计学意义(P < 0.05); 重度子痫前期组孕妇的CALLY指数低于子痫前期组和正常组,且子痫前期组低于正常组,差异有统计学意义(P < 0.05)。Pearson相关性分析结果显示, CALLY指数与平均动脉压呈负相关(r=-0.571, P < 0.001)。ROC曲线显示, CALLY指数预测子痫前期的AUC为0.941(95%CI: 0.900~0.981); 多因素Cox回归分析显示, CALLY指数升高是子痫前期发生的独立保护因素(HR=0.185, 95%CI: 0.092~0.374, P < 0.001)。
结论CALLY指数与子痫前期病情严重程度呈负相关,且是子痫前期发病的独立影响因素,可作为评估孕妇子痫前期发病及其严重程度的辅助指标。
Abstract:ObjectiveTo investigate the correlations of CALLY index in early pregnancy with the onset and severity of preeclampsia.
MethodsA total of 987 pregnant women were prospectively enrolled as study subjects, with 42 lost during follow-up, resulting in a final inclusion of 945 subjects. Based on the occurrence and severity of preeclampsia during follow-up, the pregnant women were divided into preeclampsia group (n=47), severe preeclampsia group (n=49), and normal group (n=849). General information and laboratory test results were collected from all pregnant women, and the CALLY index was calculated. The Pearson correlation analysis was used to explore the correlation between CALLY index and severity of preeclampsia (mean arterial pressure); the receiver operating characteristic (ROC) curve was plotted to analyze the predictive efficacy of each indicator for preeclampsia; Cox regression analysis was used to explore the influencing factors for the onset of preeclampsia.
ResultsThe mean arterial pressure and 24-hour urine protein levels were higher in the severe preeclampsia group than those in the preeclampsia group and normal group, and higher in the preeclampsia group than those in the normal group (P < 0.05). The CALLY index was lower in the severe preeclampsia group than in the preeclampsia group and normal group, and lower in the preeclampsia group than in the normal group (P < 0.05). Pearson correlation analysis showed a negative correlation between CALLY index and mean arterial pressure (r=-0.571, P < 0.001). The ROC curve showed that the area under the curve (AUC) of CALLY index for predicting preeclampsia was 0.941 (95%CI, 0.900 to 0.981). Multivariate Cox regression analysis showed that an increased CALLY index was an independent protective factor for the onset of preeclampsia (HR=0.185, 95%CI, 0.092 to 0.374, P < 0.001).
ConclusionThe CALLY index is negatively correlated with the severity of preeclampsia and is an independent influencing factor for the onset of preeclampsia, which can be used as an auxiliary indicator to assess the onset and severity of preeclampsia in pregnant women.
-
Keywords:
- preeclampsia /
- CALLY index /
- mean arterial pressure /
- C-reactive protein /
- albumin /
- lymphocytes
-
子痫前期是妊娠期特有的一种全身性疾病,主要表现为孕妇血压升高、蛋白尿及肝肾功能异常,还可能出现眩晕、头痛、恶心、呕吐等一系列临床症状[1]。全球范围内, 1.5%~16.7%的孕妇会受到子痫前期的影响,且每年大约有7万名产妇因此死亡,故早期筛查并及时采取干预措施具有重要的临床意义[2]。目前,临床医师主要依据血压测量、24 h尿蛋白定量以及相应的临床表现诊断子痫前期。然而,疾病初期的孕妇往往血压升高不明显,且缺乏显著的临床症状,导致确诊时病情已进展,错过最佳干预时机,增加了后期治疗的难度[3]。既往研究[4]发现,对于接受肝切除术的肝细胞癌患者而言, CALLY指数能够反映机体的营养状态和免疫炎症反应,且低CALLY指数与较低的总存活率显著相关,提示治疗前评估CALLY指数有助于早期识别预后不良的患者。本研究分析子痫前期孕妇孕10~12周时的CALLY指数水平,并探讨CALLY指数与子痫前期病情严重程度的相关性,以期为子痫前期的诊治提供参考依据。
1. 对象与方法
1.1 研究对象
前瞻性选取2022年1月—2024年1月在西安交通大学第一附属医院就诊的987例孕妇作为研究对象。纳入标准: ①单胎妊娠者; ②临床资料完整者; ③年龄20~45岁者; ④入组前未长期规律服用免疫抑制剂或激素类药物者; ⑤孕10~12周接受血清学检查者。排除标准: ①存在血液系统疾病或肿瘤病史者; ②合并哮喘、过敏等可能引发应激反应的疾病者; ③合并慢性肝炎者; ④肾功能异常者; ⑤妊娠前确诊高血压者。本研究方案已获得医院伦理委员会审核批准,所有研究对象均对研究内容知情同意,并在入组前签署知情同意书。
1.2 诊断标准
子痫前期和重度子痫前期的诊断参照《妊娠期血压管理中国专家共识(2021)》[5]。子痫前期的诊断标准: 孕20周后出现≥2次血压升高,且2次血压测量时间间隔至少6 h, 或舒张压>90 mmHg(1 mmHg=0.133 kPa), 伴尿蛋白阳性或24 h尿蛋白量>0.3 g, 但未达到重度子痫前期的标准。重度子痫前期的诊断标准(符合以下任意1项或多项条件): ①收缩压>160 mmHg、舒张压>110 mmHg; ② 24 h尿蛋白至少

1.3 随访与分组
所有入组孕妇建档后均按照孕期保健指南的标准和要求进行规律产检[6], 并随访至分娩结束。随访过程中,密切监测孕妇是否发生子痫前期及其严重程度,并记录发病时间。随访结束后,根据病情严重程度将发生子痫前期的孕妇分为子痫前期组和重度子痫前期组,其余未发生子痫前期的孕妇则纳入正常组。
1.4 资料收集
① 一般资料: 年龄、孕前体质量指数(BMI)、孕次、产次、吸烟史、饮酒史和血压。②实验室检查结果: 抽取孕妇晨起空腹静脉血4 mL, 其中2 mL使用乙二胺四乙酸二钾(EDTA-K2)抗凝,并通过Mindray BC7500全自动血细胞分析仪检测白细胞、淋巴细胞水平; 另外2 mL使用肝素锂抗凝,并通过TBA-FX8全自动生化分析仪检测白蛋白、CRP、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)等指标水平。根据以下公式计算CALLY指数, CALLY指数=白蛋白(g/L)×淋巴细胞(×109/L)/[CRP(mg/L)×10]。
1.5 统计学分析
采用SPSS 26.0软件对数据进行统计学分析。所有计量资料均进行正态性检验,符合正态分布的数据以(x±s)表示, 3组间差异比较采用单因素方差分析(one-way ANOVA); 计数资料以[n(%)]表示,组间比较采用卡方检验。绘制受试者工作特征(ROC)曲线,分析各指标对子痫前期的预测效能; 采用Pearson相关性分析法探讨CALLY指数与平均动脉压的相关性; 采用Cox回归分析探讨子痫前期发生的影响因素。检验水准统一设定为α=0.05, P < 0.05表示差异有统计学意义。
2. 结果
2.1 3组孕妇一般资料比较
截至2024年7月1日, 987例孕妇中有42例在随访过程中失访(未完成随访22例,临床资料不全20例),最终纳入945例(95.74%)孕妇进行分析。96例孕妇发生子痫前期,分为子痫前期组47例和重度子痫前期组49例; 其余849例孕妇未发生子痫前期,纳入正常组。
3组孕妇在年龄、孕次、产次、吸烟史和饮酒史方面比较,差异无统计学意义(P>0.05); 子痫前期组、重度子痫前期组的孕前BMI均高于正常组,差异有统计学意义(P < 0.05), 见表 1。
表 1 3组孕妇一般资料比较(x±s)[n(%)]指标 正常组(n=849) 子痫前期组(n=47) 重度子痫前期组(n=49) F/χ2 P 年龄/岁 30.45±4.20 30.70±4.48 30.57±4.28 0.113 0.914 孕次/次 1.71±0.69 1.68±0.72 1.63±0.70 0.214 0.610 孕前BMI/(kg/m2) 23.69±1.17 24.55±1.23 24.49±1.25 6.376 < 0.001 既往史 吸烟史 79(9.31) 4(8.51) 5(10.20) 0.623 0.854 饮酒史 75(8.83) 4(8.51) 4(8.16) 产次 初产 401(47.23) 26(55.32) 24(48.98) 0.711 0.604 经产 448(52.77) 21(44.68) 25(51.02) BMI: 体质量指数。 2.2 3组孕妇各项检查指标结果比较
3组孕妇的白细胞、淋巴细胞、TG、TC、LDL-C、ALT、AST、白蛋白及CRP水平比较,差异均无统计学意义(P>0.05); 重度子痫前期组孕妇的平均动脉压、24 h尿蛋白水平高于子痫前期组和正常组,且子痫前期组高于正常组,差异有统计学意义(P < 0.05); 重度子痫前期组孕妇的CALLY指数低于子痫前期组和正常组,且子痫前期组低于正常组,差异有统计学意义(P < 0.05)。见表 2。
表 2 3组孕妇实验室检查指标、CALLY指数及平均动脉压水平比较(x±s)指标 正常组(n=849) 子痫前期组(n=47) 重度子痫前期组(n=49) F P 白细胞/(×109/L) 6.02±0.88 6.00±0.98 6.08±0.84 0.090 0.914 淋巴细胞/(×109/L) 1.74±0.27 1.80±0.23 1.79±0.20 2.813 0.063 TG/(mmol/L) 1.89±0.43 1.86±0.45 1.87±0.38 2.321 0.104 TC/(mmol/L) 5.61±0.88 5.55±0.91 5.63±0.92 2.012 0.141 LDL-C/(mmol/L) 3.09±0.59 3.11±0.55 3.14±0.71 1.032 0.453 ALT/(U/L) 24.23±4.58 25.12±6.21 24.83±4.60 2.112 0.132 AST/(U/L) 19.02±3.41 19.78±4.22 19.85±4.32 1.983 0.212 24 h尿蛋白/g 0.11±0.08 1.08±0.41 4.52±0.56 35.246 < 0.001 白蛋白/(g/L) 40.43±4.83 40.13±4.77 40.20±4.67 0.058 0.943 CRP/(mg/L) 1.56±0.39 1.55±0.27 1.57±0.31 2.209 0.113 CALLY指数 1.96±0.33 1.60±0.16 0.81±0.32 263.300 < 0.001 平均动脉压/mmHg 96.34±5.80 108.17±5.42 124.96±5.00 360.818 < 0.001 TG: 甘油三酯; TC: 总胆固醇; LDL-C: 低密度脂蛋白胆固醇; ALT: 丙氨酸氨基转移酶; AST: 天门冬氨酸氨基转移酶; CRP: C反应蛋白。24 h尿蛋白为孕20周以后测量结果。 2.3 血清白蛋白、淋巴细胞、白细胞、CRP及CALLY指数对子痫前期的预测效能
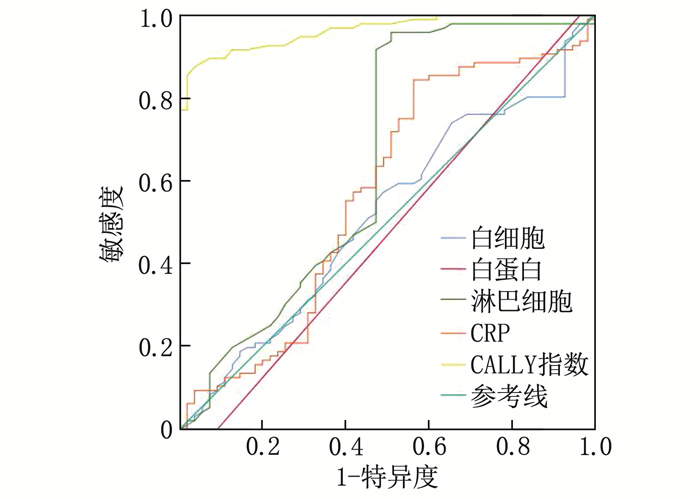
ROC曲线分析结果显示,血清白蛋白、淋巴细胞、白细胞、CRP、CALLY指数预测子痫前期的曲线下面积(AUC)分别为0.485(95%CI: 0.389~0.582)、0.548(95%CI: 0.455~0.642)、0.546 (95%CI: 0.451~0.641)、0.626(95%CI: 0.533~0.719)、0.941(95%CI: 0.900~0.981), 其中CALLY指数的AUC最大,对子痫前期的预测效能最高,见表 3、图 1。
表 3 不同指标对子痫前期的预测效能指标 曲线下面积 95%CI P 白蛋白 0.485 0.389~0.582 0.770 淋巴细胞 0.548 0.455~0.642 0.336 白细胞 0.546 0.451~0.641 0.363 CRP 0.626 0.533~0.719 0.058 CALLY指数 0.941 0.900~0.981 < 0.001 2.4 CALLY指数与子痫前期病情严重程度的相关性分析
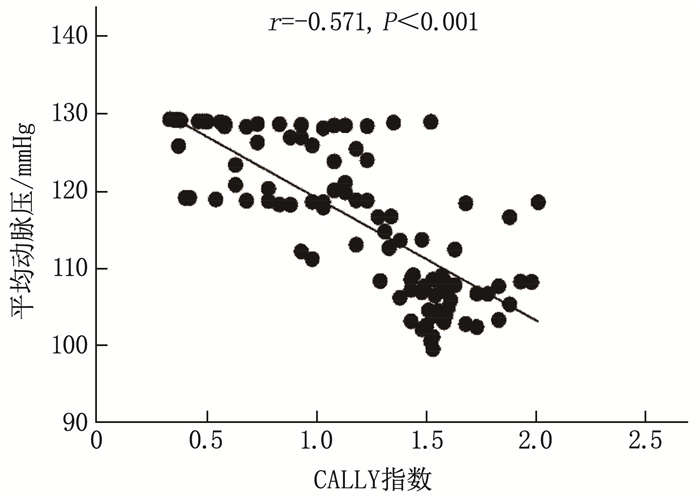
以平均动脉压水平作为子痫前期病情严重程度的评价标准,采用Pearson相关性分析法探讨孕妇平均动脉压与CALLY指数的相关性。分析结果显示,随着CALLY指数的升高,孕妇的平均动脉压水平呈现降低趋势,表明CALLY指数与子痫前期病情严重程度(平均动脉压)呈负相关(r=-0.571, P < 0.001), 见图 2。
2.5 子痫前期的多因素Cox回归分析
以是否发生子痫前期为因变量(是=1, 否=0), 以年龄、孕次、产次、孕前BMI、吸烟史、饮酒史、CALLY指数、白蛋白、白细胞、淋巴细胞、CRP为自变量,进行多因素Cox回归分析。分析结果显示, CALLY指数升高为子痫前期发生的独立保护因素(HR=0.185, 95%CI: 0.092~0.374, P < 0.001), 孕前BMI高(HR=8.457, 95%CI: 1.528~46.809, P=0.014)、有饮酒史(HR=7.576, 95%CI: 1.308~43.687, P=0.024)是子痫前期发生的独立危险因素,见表 4。
表 4 子痫前期的多因素Cox回归分析结果因素 β SE Wald P HR 95%CI 年龄 0.186 0.109 2.908 0.088 1.204 0.973~1.492 孕次 -0.051 0.926 0.003 0.956 0.950 0.155~5.838 产次 -0.468 1.424 0.108 0.743 0.626 0.038~10.211 孕前BMI 2.135 0.873 5.981 0.014 8.457 1.528~46.809 吸烟史 1.124 0.966 1.354 0.245 3.077 0.463~20.437 饮酒史 2.025 0.896 5.108 0.024 7.576 1.308~43.687 CALLY指数 -1.685 0.358 22.153 < 0.001 0.185 0.092~0.374 白蛋白 -0.572 0.418 1.873 0.171 0.564 0.249~1.281 白细胞 1.316 0.727 3.277 0.070 3.728 0.897~15.501 淋巴细胞 -2.159 1.910 1.278 0.258 0.115 0.003~4.877 CRP 0.906 0.624 2.108 0.147 2.474 0.728~8.407 3. 讨论
子痫前期是一种多系统疾病,常发生在妊娠中期,主要症状为高血压、尿蛋白升高、头痛及上腹不适,但其发病机制目前尚未完全明确。多数子痫前期患者的早期症状不明显,且这些症状易受到其他基础疾病或合并症的影响,导致早期诊断困难[7-8]。若未及时治疗,子痫前期可能进展为重度子痫前期,引发小血管痉挛、局部缺血坏死,甚至导致脑出血、心力衰竭、大出血、肝肾功能衰竭等一系列并发症,严重危害孕妇及其胎儿的健康[3, 9]。
孕育胎儿的过程可视为一种半同种异体移植反应[10], 导致母体处于持续的全身炎症反应状态。妊娠早期,母体对父源抗原产生耐受,随后人类白细胞抗原C被绒毛滋养层中的T淋巴细胞识别,并在吲哚胺2, 3-双加氧酶的调控下发挥免疫调节作用,促进胎盘生长[11]。因此,子痫前期被认为是由母体对胎儿这一半同种异体移植物产生过度免疫反应所致。在此过程中,子宫螺旋动脉出现病理性狭窄[10], 造成胎盘血流量减少,进而引起胎盘绒毛间隙含氧血液和营养物质供应不足,导致组织缺血和再灌注损伤[12], 诱发氧化应激反应,并释放大量活性氧[13]。这会刺激胎盘释放大量炎症因子和趋化因子[14],进而激活外周血中的炎症细胞。
子痫前期的发生和发展与孕妇自身的营养状况和全身血管炎症反应密切相关。中性粒细胞与淋巴细胞比值(NLR)是评估炎症与免疫平衡的有效指标[15], 既往研究[16-17]表明,与子痫前期孕妇和健康孕妇相比,重度子痫前期孕妇的NLR显著升高。全身炎症反应指数(SIRI)常被用于评估全身炎症及免疫应答的平衡状态[18-19], SEYHANLI Z等[20]研究发现,子痫前期患者的SIRI显著升高,有助于区分子痫前期患者与健康孕妇。CALLY指数结合了营养状态指标(血清白蛋白)与免疫炎症反应指标(血清CRP和淋巴细胞)[21], 对肝切除后肝癌患者的预后具有良好的预测作用[4], 可反映患者的整体状况。本研究中,正常组、子痫前期组和重度子痫前期组孕妇的血清白蛋白、CRP和淋巴细胞水平在孕10~12周时并无显著差异,但重度子痫前期组的CALLY指数显著低于子痫前期组和正常组,且子痫前期组显著低于正常组,表明CALLY指数与病情严重程度存在关联。研究[22]表明,平均动脉压预测子痫前期的敏感度高于收缩压或舒张压,因此被广泛应用于临床筛查,也可用于评估病情严重程度和再入院风险。本研究还发现, CALLY指数与平均动脉压呈负相关,即CALLY指数越低,患者病情越严重,发生重度子痫前期的风险越高。因此,临床医师应随访观察孕妇的CALLY指数水平,对于CALLY指数显著降低者,应高度重视子痫前期的筛查与预防,必要时采取适当干预措施。
本研究进一步通过ROC曲线发现, CALLY指数预测子痫前期的AUC为0.941(95%CI: 0.900~0.981), 显著大于白蛋白、淋巴细胞、白细胞、CRP预测子痫前期的AUC, 提示孕10~12周时CALLY指数可用作子痫前期的辅助检测指标。CALLY指数计算极为简便,仅需常规血细胞检查和生化检测结果即可得出,具有较高的便捷性和适用性,有助于早期预测子痫前期,从而降低孕妇及其胎儿的病死率。值得注意的是,子痫前期的发生由多种因素引起,包括母体因素、既往病史及自身免疫性疾病等,临床应综合评估这些因素,以提高子痫前期的检出率并尽早干预。
综上所述,子痫前期患者在妊娠早期即可出现CALLY指数异常,且CALLY指数越低,发生重度子痫前期的风险越大。CALLY指数可辅助诊断子痫前期,定期监测其变化并结合其他高危因素,有助于临床医生早期识别子痫前期孕妇,从而及时采取合理的防治措施,降低子痫前期的发病率和致死率。
-
表 1 3组孕妇一般资料比较(x±s)[n(%)]
指标 正常组(n=849) 子痫前期组(n=47) 重度子痫前期组(n=49) F/χ2 P 年龄/岁 30.45±4.20 30.70±4.48 30.57±4.28 0.113 0.914 孕次/次 1.71±0.69 1.68±0.72 1.63±0.70 0.214 0.610 孕前BMI/(kg/m2) 23.69±1.17 24.55±1.23 24.49±1.25 6.376 < 0.001 既往史 吸烟史 79(9.31) 4(8.51) 5(10.20) 0.623 0.854 饮酒史 75(8.83) 4(8.51) 4(8.16) 产次 初产 401(47.23) 26(55.32) 24(48.98) 0.711 0.604 经产 448(52.77) 21(44.68) 25(51.02) BMI: 体质量指数。 表 2 3组孕妇实验室检查指标、CALLY指数及平均动脉压水平比较(x±s)
指标 正常组(n=849) 子痫前期组(n=47) 重度子痫前期组(n=49) F P 白细胞/(×109/L) 6.02±0.88 6.00±0.98 6.08±0.84 0.090 0.914 淋巴细胞/(×109/L) 1.74±0.27 1.80±0.23 1.79±0.20 2.813 0.063 TG/(mmol/L) 1.89±0.43 1.86±0.45 1.87±0.38 2.321 0.104 TC/(mmol/L) 5.61±0.88 5.55±0.91 5.63±0.92 2.012 0.141 LDL-C/(mmol/L) 3.09±0.59 3.11±0.55 3.14±0.71 1.032 0.453 ALT/(U/L) 24.23±4.58 25.12±6.21 24.83±4.60 2.112 0.132 AST/(U/L) 19.02±3.41 19.78±4.22 19.85±4.32 1.983 0.212 24 h尿蛋白/g 0.11±0.08 1.08±0.41 4.52±0.56 35.246 < 0.001 白蛋白/(g/L) 40.43±4.83 40.13±4.77 40.20±4.67 0.058 0.943 CRP/(mg/L) 1.56±0.39 1.55±0.27 1.57±0.31 2.209 0.113 CALLY指数 1.96±0.33 1.60±0.16 0.81±0.32 263.300 < 0.001 平均动脉压/mmHg 96.34±5.80 108.17±5.42 124.96±5.00 360.818 < 0.001 TG: 甘油三酯; TC: 总胆固醇; LDL-C: 低密度脂蛋白胆固醇; ALT: 丙氨酸氨基转移酶; AST: 天门冬氨酸氨基转移酶; CRP: C反应蛋白。24 h尿蛋白为孕20周以后测量结果。 表 3 不同指标对子痫前期的预测效能
指标 曲线下面积 95%CI P 白蛋白 0.485 0.389~0.582 0.770 淋巴细胞 0.548 0.455~0.642 0.336 白细胞 0.546 0.451~0.641 0.363 CRP 0.626 0.533~0.719 0.058 CALLY指数 0.941 0.900~0.981 < 0.001 表 4 子痫前期的多因素Cox回归分析结果
因素 β SE Wald P HR 95%CI 年龄 0.186 0.109 2.908 0.088 1.204 0.973~1.492 孕次 -0.051 0.926 0.003 0.956 0.950 0.155~5.838 产次 -0.468 1.424 0.108 0.743 0.626 0.038~10.211 孕前BMI 2.135 0.873 5.981 0.014 8.457 1.528~46.809 吸烟史 1.124 0.966 1.354 0.245 3.077 0.463~20.437 饮酒史 2.025 0.896 5.108 0.024 7.576 1.308~43.687 CALLY指数 -1.685 0.358 22.153 < 0.001 0.185 0.092~0.374 白蛋白 -0.572 0.418 1.873 0.171 0.564 0.249~1.281 白细胞 1.316 0.727 3.277 0.070 3.728 0.897~15.501 淋巴细胞 -2.159 1.910 1.278 0.258 0.115 0.003~4.877 CRP 0.906 0.624 2.108 0.147 2.474 0.728~8.407 -
[1] JUNG E, ROMERO R, YEO L, et al. The etiology of preeclampsia[J]. Am J Obstet Gynecol, 2022, 226(2): S844-S866. doi: 10.1016/j.ajog.2021.11.1356
[2] IVES C W, SINKEY R, RAJAPREYAR I, et al. Preeclampsia: pathophysiology and clinical presentations JACC state-of-the-art review[J]. J Am Coll Cardiol, 2020, 76(14): 1690-1702. doi: 10.1016/j.jacc.2020.08.014
[3] 潘洁怡, 史蓓, 杨优维, 等. 24 h动态血压监测联合血清NT-proBNP、T-cadherin水平对子痫前期孕妇围生期结局的预测价值[J]. 山东医药, 2023, 63(13): 15-19. doi: 10.3969/j.issn.1002-266X.2023.13.004 [4] IIDA H, TANI M, KOMEDA K, et al. Superiority of CRP-albumin-lymphocyte index (CALLY index) as a non-invasive prognostic biomarker after hepatectomy for hepatocellular carcinoma[J]. HPB: Oxford, 2022, 24(1): 101-115. doi: 10.1016/j.hpb.2021.06.414
[5] 中华医学会妇产科学分会妊娠期高血压疾病学组. 妊娠期血压管理中国专家共识(2021)[J]. 中华妇产科杂志, 2021, 56(11): 737-745. doi: 10.3760/cma.j.cn112141-20210506-00251 [6] PEAHL A F, HOWELL J D. The evolution of prenatal care delivery guidelines in the United States[J]. Am J Obstet Gynecol, 2021, 224(4): 339-347. doi: 10.1016/j.ajog.2020.12.016
[7] YANG Y, LE RAY I, ZHU J, et al. Preeclampsia prevalence, risk factors, and pregnancy outcomes in Sweden and China[J]. JAMA Netw Open, 2021, 4(5): e218401. doi: 10.1001/jamanetworkopen.2021.8401
[8] CHAPPELL L C, CLUVER C A, KINGDOM J, et al. Pre-eclampsia[J]. Lancet, 2021, 398(10297): 341-354. doi: 10.1016/S0140-6736(20)32335-7
[9] TANNE J H. Pre-eclampsia: FDA approves blood test to identify pregnant women at risk[J]. BMJ, 2023, 382: 1594.
[10] DAS U N. Cytokines, angiogenic, and antiangiogenic factors and bioactive lipids in preeclampsia[J]. Nutrition, 2015, 31(9): 1083-1095. doi: 10.1016/j.nut.2015.03.013
[11] STAFF A C, JOHNSEN G M, DECHEND R, et al. Preeclampsia and uteroplacental acute atherosis: immune and inflammatory factors[J]. J Reprod Immunol, 2014, 101: 120-126.
[12] CHAIWORAPONGSA T, ROMERO R, GOMEZ-LOPEZ N, et al. Preeclampsia at term: evidence of disease heterogeneity based on the profile of circulating cytokines and angiogenic factors[J]. Am J Obstet Gynecol, 2024, 230(4): 450. e1-450. e18. doi: 10.1016/j.ajog.2023.10.002
[13] EREZ O, ROMERO R, JUNG E, et al. Preeclampsia and eclampsia: the conceptual evolution of a syndrome[J]. Am J Obstet Gynecol, 2022, 226(2s): S786-S803. http://www.sciencedirect.com/science/article/pii/S0002937821026399
[14] MURTHI P, PINAR A A, DIMITRIADIS E, et al. Inflammasomes-a molecular link for altered immunoregulation and inflammation mediated vascular dysfunction in preeclampsia[J]. Int J Mol Sci, 2020, 21(4): E1406. doi: 10.3390/ijms21041406
[15] ASLAN M M, YELER M T, YUVAC? H U, et al. Can the neutrophil-to-lymphocyte ratio (NLR) predicts fetal loss in preeclampsia with severe features?[J]. Pregnancy Hypertens, 2020, 22: 14-16. doi: 10.1016/j.preghy.2020.07.005
[16] CHEN Y, MIAO C, ZHAO Y, et al. Inflammasomes in human reproductive diseases[J]. Mol Hum Reprod, 2023, 29(10): gaad035. doi: 10.1093/molehr/gaad035
[17] OGLAK S C, TUNÇ Ş, ÖLMEZ F. First trimester mean platelet volume, neutrophil to lymphocyte ratio, and platelet to lymphocyte ratio values are useful markers for predicting preeclampsia[J]. Ochsner J, 2021, 21(4): 364-370. doi: 10.31486/toj.21.0026
[18] KAPCI M, SENER K, CAKIR A, et al. Prognostic value of systemic immune-inflammation index in the diagnosis of preeclampsia[J]. Heliyon, 2024, 10(6): e28181. doi: 10.1016/j.heliyon.2024.e28181
[19] WNUK A, STANGRET A, WATROBA M, et al. Can adipokine visfatin be a novel marker of pregnancy-related disorders in women with obesity?[J]. Obes Rev, 2020, 21(7): e13022. doi: 10.1111/obr.13022
[20] SEYHANLI Z, BAYRAKTAR B, BAYSOZ O B, et al. The role of first trimester serum inflammatory indexes (NLR, PLR, MLR, SII, SIRI, and PIV) and the β-hCG to PAPP-a ratio in predicting preeclampsia[J]. J Reprod Immunol, 2024, 162: 104190. doi: 10.1016/j.jri.2023.104190
[21] TSAI Y T, KO C A, CHEN H C, et al. Prognostic value of CRP-albumin-lymphocyte (CALLY) index in patients undergoing surgery for oral cavity cancer[J]. J Cancer, 2022, 13(10): 3000-3012. doi: 10.7150/jca.74930
[22] LIN B X, SMITH M, SUTTER M, et al. Association between peripartum mean arterial pressure and postpartum readmission for preeclampsia with severe features[J]. Am J Perinatol, 2024, 41(s01): e2188-e2194. doi: 10.1055/s-0043-1770705




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号