Role and mechanism of P2Y12 receptor in microglia in central post-stroke pain in mice
-
摘要:目的
探讨小胶质细胞P2Y12受体在小鼠卒中后中枢痛中的作用及机制。
方法选取无特定病原体(SPF)级雄性C57BL/6J小鼠32只, 7~8周龄,体质量25~30 g, 采用随机数字表法分为4组: 假手术组(C组)、CPSP组、CPSP-M组(CPSP+P2Y12受体拮抗剂MRS2395)、C-M组(假手术+P2Y12受体拮抗剂MRS2395),每组8只。采用右侧丘脑腹后内侧核和腹后外侧核内注射10 nL 0.001 U/nL Ⅳ型胶原酶制备CPSP模型。CPSP-M组和C-M组在CPSP模型制备前30 min时腹腔注射MRS 2395(1.5 mg/kg), 1次/d, 连续注射5 d; C组和CPSP组给予等量生理盐水。造模前1 d(T0)和造模后1、3、5 d(T1、T2、T3)时测定热缩足潜伏期(TWL)、冷缩足潜伏期(CWL)和机械缩足反应频率(PWF)。随后处死小鼠取脑组织,采用免疫荧光法观察P2Y12受体的表达部位,苏木精-伊红(HE)染色法观察脑组织病理改变,蛋白质印迹法检测脑组织P2Y12受体、Toll样受体4(TLR4)、磷酸化核转录因子κB-p65(p-NF-κB p65)和NF-κB p65的表达水平。
结果P2Y12受体在CPSP组脑组织内只表达于小胶质细胞中,星形胶质细胞和神经元中未表达。与C组比较, CPSP组和CPSP-M组T1~T3时TWL、CWL缩短, PWF升高,脑组织损伤程度加重, P2Y12受体、TLR4和p-NF-κB p65表达上调, C-M组T1~T3时以上各项指标与C组比较,差异无统计学意义(P>0.05); 与CPSP组比较, CPSP-M组T1~T3时TWL、CWL延长,PWF降低,脑组织损伤程度减轻, P2Y12受体、TLR4和p-NF-κB p65表达下调(P < 0.05)。
结论小胶质细胞P2Y12受体可能通过激活TLR4/NF-κB信号通路参与小鼠CPSP的形成。
Abstract:ObjectiveTo evaluate the role of P2Y12 receptor in microglia in central post-stroke pain (CPSP) in mice and its mechanism.
MethodsThirty-two specific pathogen-free(SPF)-grade male C57BL/6J mice were selected, aged 7 to 8 weeks, weighing 25 to 30 g, were divided into four groups using a random number table method: C group (sham operation group, n=8), CPSP group (n=8), CPSP-M group (CPSP plus P2Y12 receptor inhibitor MRS2395, n=8) and C-M group (sham operation plus P2Y12 receptor inhibitor MRS2395, n=8). CPSP model was induced by injecting 10 nL type Ⅳ collagenase(0.001 U/nL) into the right ventral posterior medial nucleus andventral posterior lateral nucleus. MRS2395(1.5 mg/kg) was injected intraperitoneally at 30 min before model preparation in CPSP-M group and C-M group and then injected once a day for 5 consecutive days, mice in C group and CPSP group were given saline at the same volume. Before the modeling (T0) and 3, 7 and 14 days (T1, T2, T3) after the establishment of the model, the thermal withdrawal latency (TWL), cold withdrawal latency (CWL) and paw withdrawal frequency (PWF) were measured. The mice were then sacrificed and the brain tissues were obtained for observing the location of P2Y12receptor by double immunofluorescence staining and the pathological changes by HE staining, and for determination of the expression levels of P2Y12 receptor, toll-like receptor 4 (TLR4), phospho-nuclear factor-κB p65 (p-NF-κB p65) and NF-κB p65 by western blot.
ResultsP2Y12 receptor was co-localized only with microglia, but not with neurons or astrocytes in brain tissue of CPSP group. Compared with C group, the TWL and CWL were significantly reduced and the PWF was significantly increased at T1 to T3, cerebral injury was aggravated significantly and the expressions of P2Y12 receptor, TLR4 and p-NF-κB p65 in brain tissue were up-regulated in CPSP group and CPSP-M group (P < 0.05). There was no statistically significant difference between C group and C-M group in the above indicators (P>0.05). Compared with CPSP group, the TWL and CWL were significantly prolonged and the PWF was significantly reduced at T1 to T3, cerebral injury was relieved significantly and the expressions of P2Y12 receptor, TLR4 and p-NF-κB p65 in brain tissue were down-regulated in CPSP group and CPSP-M group (P < 0.05).
ConclusionP2Y12 receptors in microglia may be involved in the development of CPSP by activating TLR4/NF-κB signaling pathway in mice.
-
Keywords:
- P2Y12 receptor /
- microglia /
- central nervous system /
- pain
-
卒中后中枢痛(CPSP)是卒中后出现的肢体间歇性或持续性疼痛,常表现为痛觉过敏、感觉异常及自发性疼痛,严重影响患者的生活质量和预后[1]。丘脑是脑出血最常见部位之一,也是最重要的痛觉整合系统,丘脑出血后CPSP的发生率高达50%[2-3]。由于CPSP发病机制尚未阐明,目前CPSP治疗和预防仍然是临床的重点和难题。本课题组前期研究[4-5]发现,丘脑出血后小胶质细胞的过度激活以及相关的炎症反应是启动和维持CPSP的关键因素。P2Y受体是ATP等核苷酸的生理性受体。近年来, P2Y受体在神经病理性疼痛中的研究不断深入,尤其是小胶质细胞上特异性表达的亚型P2Y12受体备受关注[6-7]。已有研究[8]发现,阻断P2Y12受体可有效抑制周围神经损伤诱导的脊髓小胶质细胞激活及痛觉超敏。然而, P2Y12受体在CPSP的发生、发展中是否也扮演着重要角色,目前尚有待探讨。本研究拟探讨P2Y12受体在CPSP中的关键作用,并探讨相关分子机制,以期为临床治疗CPSP提供理论依据。
1. 材料与方法
1.1 实验分组
选择无特定病原体(SPF)级雄性C57BL/6J小鼠32只, 7~8周龄,体质量25~30 g, 由江苏集萃药康生物科技有限公司提供,许可证号2018-0008。将小鼠饲养于清洁级环境,适应1周后,按照随机数字表法分为4组: C组(n=8, 假手术组)、CPSP组(n=8)、CPSP-M组(n=8, CPSP+P2Y12受体拮抗剂MRS2395)、C-M组(n=8, 假手术+P2Y12受体拮抗剂MRS2395)。
1.2 CPSP模型构建
参照文献[5]的方法制备小鼠丘脑出血后CPSP模型。腹腔注射质量分数为0.3%的戊巴比妥钠30 mg/kg将小鼠麻醉后,通过立体定向仪采用玻璃微量注射器将10 nL 0.001U/nL Ⅳ型胶原酶(Sigma公司,美国)注射至小鼠右侧丘脑腹后内侧核和腹后外侧核。注射完毕,固定注射器位置持续25 min以使Ⅳ型胶原酶完全分散,随后碘伏清理创面并缝合头皮。C组注射等量无菌生理盐水,其余操作同CPSP组。CPSP-M组和C-M组小鼠在模型制备前30 min腹腔注射MRS2395(Sigma公司,美国)1.5 mg/kg, 此后注射1次/d, 连续注射5 d。C组和CPSP组小鼠每日注射等量生理盐水。
1.3 疼痛行为学测定
模型制备前1 d(T0)、造模后1、3和5 d(T1、T2、T3)时分别测定各组小鼠的热缩足潜伏期(TWL)、冷缩足潜伏期(CWL)和机械缩足反应频率(PWF), 所有测定均在上午固定时间(8: 00—12: 00)及安静环境中进行。
TWL测定: 将小鼠置于玻璃笼内适应15 min后,采用热辐射测痛仪(天津伯尔尼科技有限公司)照射其左后足底中心部位,记录小鼠出现缩足反应的时间,共进行5次,每次测定至少间隔5 min, 取平均值为小鼠的TWL。CWL测定: 将铝板置于冰面上,待其温度稳定于(4.0±1.0) ℃时,将小鼠放于铝板表面,记录小鼠左后足出现缩足反应的时间,共进行3次,每次测定至少间隔10 min, 取平均值为小鼠的CWL。PWF测定: 将小鼠置于底部为金属网的玻璃箱中适应15 min, 使用0.07 g规格von-Frey纤毛(Stoelting公司,美国)刺激小鼠左后足底中心区域,每次持续1~2 s, 若小鼠出现缩足反应记为阳性,重复刺激10次,每次间隔10~15 s, 阳性结果与总反应的百分比即为PWF。
1.4 免疫荧光法检测脑组织P2Y12受体与离子化钙结合适配分子1(Iba1)、星形胶质细胞标志物胶质纤维酸性蛋白(GFAP)和神经元标志物神经元细胞核(NeuN)共表达情况
造模后第5天疼痛行为测定完成后,每组随机取4只小鼠,麻醉后使用预冷生理盐水和4%多聚甲醛进行心脏灌注。灌注完成后断头取脑组织,将包含损伤区域的脑组织块固定脱水后用石蜡包埋。
取包埋好的CPSP组脑组织石蜡块,做7 μm的连续冠状切片,脱蜡、水化及抗原修复后,再以5%山羊血清室温下封闭1 h。随后将切片分别与P2Y12抗体(1∶ 200, Anaspec公司,美国)、Iba1抗体(1∶ 200, Abcam公司,英国)、GFAP抗体(1∶ 200, Abcam公司,英国)和NeuN抗体(1∶ 500, Abcam公司,英国)在4 ℃下孵育过夜,磷酸盐缓冲液(PBS)漂洗后,与FITC及CY3荧光二抗(1∶ 200, Jackson公司,美国)一起在室温下孵育2 h。PBS再次漂洗后, DAPI复染细胞核并封片,在荧光显微镜下观察染色结果。
1.5 苏木精-伊红(HE)染色法观察脑组织病理变化情况
取包埋好的各组小鼠脑组织石蜡块,冠状切片(厚度为5 μm), 脱蜡至水后行HE染色法,烘干后用中性树脂封片,光学显微镜下观察染色结果。
1.6 蛋白质印迹法(Western blot)检测脑组织内P2Y12受体、Toll样受体4(TLR4)、磷酸化核转录因子κB-p65(p-NF-κB p65)及NF-κB p65蛋白表达水平
取每组剩余的4只小鼠,处死后取损伤脑组织前后约2 mm的组织块,加入组织裂解液和蛋白酶抑制剂,充分匀浆。冰面静置30 min后,于4 ℃温度下以12 000转/min离心15 min,离心半径8 cm。取上清液采用二喹啉甲酸试验法(BCA)测定蛋白浓度,随后加入上样缓冲液水浴变性。经SDS-聚丙烯酰胺凝胶电泳分离蛋白后转移至PVDF膜上,脱脂奶粉封闭1 h后分别加入P2Y12受体(1∶ 2000, Abcam公司,英国)、TLR4(1∶ 1 000, 武汉三鹰生物技术有限公司)、p-NF-κBp65(1∶ 1 000, Abcam公司,英国)、NF-κBp65(1∶ 1000,Abcam公司,英国)及β-actin(1∶ 5 000, CST公司,美国)一抗, 4 ℃孵育过夜。采用Tris Buffered Saline with Tween-20(TBST)漂洗后加入辣根过氧化物酶标记的二抗(1∶ 5 000, 武汉三鹰生物技术有限公司)室温孵育1 h, TBST再次漂洗后增强型化学发光试剂(ECL)发光试剂显色。使用ImageJ图像软件分析蛋白条带灰度值并计算相对表达量。
1.7 统计学分析
采用SPSS 23.0软件进行数据分析,符合正态分布的计量资料以(x±s)表示,组间比较采用单因素方差分析, P < 0.05为差异有统计学意义。
2. 结果
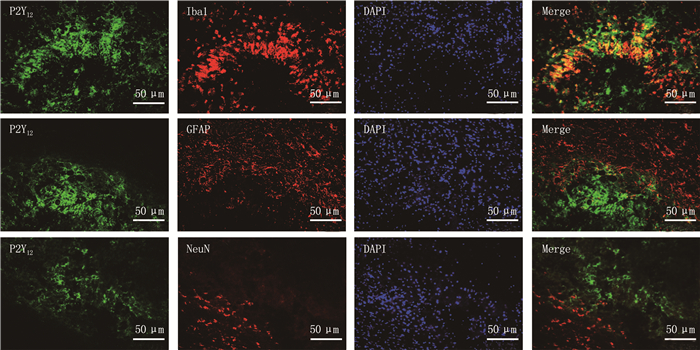
2.1 CPSP组小鼠脑组织P2Y12受体与Iba1、GFAP和NeuN共表达情况
免疫荧光检测结果显示, P2Y12受体(绿色)在CPSP小鼠脑组织内仅与小胶质细胞标记物Iba1(红色)存在共定位(黄色),与星形胶质细胞标记物GFAP或神经元标记物NeuN不存在共定位,见图 1。
2.2 各组小鼠TWL比较
CPSP模型制备前,各组小鼠TWL比较,差异无统计学意义(P>0.05)。模型建立后, CPSP组和CPSP-M组T1、T2和T3时TWL较C组缩短,差异有统计学意义(P < 0.05), C-M组T1、T2和T3时TWL与C组比较,差异无统计学意义(P>0.05); 与CPSP组比较, CPSP-M组T1、T2和T3时TWL延长,差异有统计学意义(P < 0.05), 见表 1。
表 1 4组小鼠不同时点热缩足潜伏期比较(x±s)s 组别 T0 T1 T2 T3 C组 14.5±1.6 14.2±1.2 13.9±1.7 14.1±1.6 CPSP组 14.2±1.4 9.5±1.3* 7.9±0.9* 4.8±1.1* CPSP-M组 14.1±1.9 12.3±1.5*# 10.9±1.7*# 8.5±1.1*# C-M组 14.6±1.5 14.1±1.7 13.6±1.6 13.9±1.2 T0: 模型制备前1 d; T1: 造模后1 d; T2: 造模后3 d; T3: 造模后5 d。与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 2.3 各组小鼠CWL比较
CPSP模型制备前,各组小鼠CWL比较,差异无统计学意义(P>0.05)。模型建立后,与C组比较,CPSP组和CPSP-M组T1、T2和T3时CWL缩短, C-M组T1、T2和T3时CWL比较,差异无统计学意义(P>0.05); 与CPSP组比较, CPSP-M组T1、T2和T3时CWL延长,差异有统计学意义(P < 0.05), 见表 2。
表 2 4组小鼠不同时点冷缩足潜伏期比较(x±s)s 组别 T0 T1 T2 T3 C组 19.1±2.1 20.4±2.2 18.3±3.6 18.7±2.4 CPSP组 19.5±2.1 14.8±2.7* 11.6±2.4* 7.5±1.6* CPSP-M组 19.9±3.4 17.6±2.3*# 14.2±2.2*# 11.6±1.5*# C-M组 19.7±2.9 20.6±2.8 18.5±2.3 18.7±2.8 与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 2.4 各组小鼠PWF比较
CPSP模型制备前,各组小鼠PWF比较,差异无统计学意义(P>0.05)。模型建立后,与C组比较, CPSP组和CPSP-M组T1、T2和T3时PWF升高,但C-M组T1、T2和T3时PWF与C组比较,差异无统计学意义(P>0.05); 与CPSP组比较, CPSP-M组T1、T2和T3时PWF降低,差异有统计学意义(P < 0.05), 见表 3。
表 3 4组小鼠不同时点机械缩足反应频率比较(x±s)% 组别 T0 T1 T2 T3 C组 12.5±8.9 11.3±8.3 12.5±10.4 13.8±7.4 CPSP组 11.3±8.3 43.8±9.2* 68.8±12.5* 88.8±14.6* CPSP-M组 12.5±7.1 33.8±5.2*# 47.5±8.9*# 57.5±14.9*# C-M组 13.8±7.4 12.5±7.1 13.8±10.6 16.3±7.4 与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 2.5 各组小鼠脑组织病理变化情况
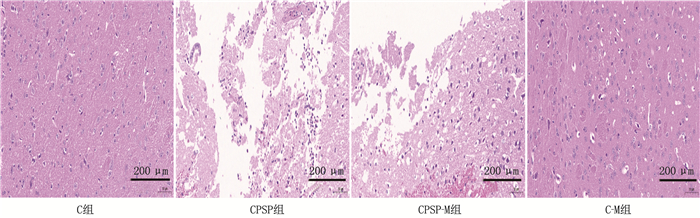
光镜下, C组和C-M组小鼠脑组织形态正常,神经细胞分布均匀,核仁清晰可见; CPSP组小鼠脑组织形态明显异常,神经细胞肿胀,细胞核固缩,核仁浓染甚至破裂; 与CPSP组比较, CPSP-M组小鼠脑组织形态显著改善,神经细胞肿胀减轻,固缩坏死的细胞数量减少,见图 2。
2.6 各组小鼠脑组织中P2Y12受体、TLR4、p-NF-κB p65及NF-κB p65蛋白表达水平
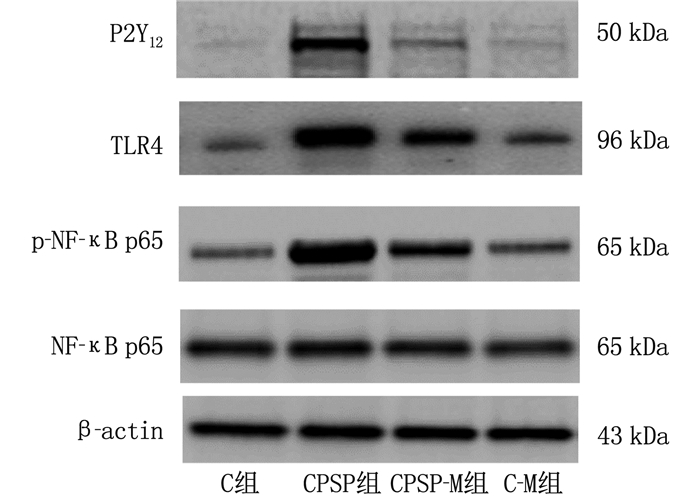
与C组比较, CPSP组和CPSP-M组脑组织中P2Y12受体、TLR4和p-NF-κB p65表达上调, C-M组脑组织中P2Y12受体、TLR4和p-NF-κB p65表达水平与C组比较,差异无统计学意义(P>0.05); 与CPSP组比较, CPSP-M组脑组织中P2Y12受体、TLR4和p-NF-κB p65表达下调,差异有统计学意义(P < 0.05), 见表 4、图 3。
表 4 4组小鼠脑组织中P2Y12受体、TLR4和p-NF-κB p65表达比较(x±s, n=4)组别 P2Y12/β-actin TLR4/β-actin p-NF-κB p65/NF-κB p65 C组 0.09±0.03 0.29±0.07 0.35±0.04 CPSP组 0.75±0.12* 1.12±0.23* 1.11±0.16* CPSP-M组 0.34±0.07*# 0.79±0.07*# 0.73±0.06*# C-M组 0.11±0.02 0.31±0.04 0.42±0.07 TLR4: Toll样受体4; p-NF-κB p65: 磷酸化核转录因子κB-p65。与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 3. 讨论
单侧丘脑腹后内侧核和腹后外侧核注射Ⅳ型胶原酶可有效诱导痛觉超敏反应,表现为对侧肢体冷热痛觉过敏和机械痛觉异常,与人类丘脑出血后CPSP具有相似的病理和生理学特点[9-11]。基于此,本研究参照文献[5]使用小鼠复制该模型,结果显示,模型构建后各时点小鼠时PWF升高, TWL、CWL降低,提示小鼠CPSP模型构建成功。
目前,关于CPSP机制研究主要集中在神经炎症、去抑制和中枢敏化等方面,其中神经炎症在CPSP发生、发展中的作用越来越受到重视[12]。小胶质细胞是遍布脊髓和大脑的一种神经胶质细胞,为神经炎症的主要介质[13]。在脑出血早期,小胶质细胞过度活化后可释放大量促炎介质,造成继发性脑损伤并导致CPSP的发生、发展[14]。本课题组前期研究[4-5]同样证实小胶质细胞过度激活以及相关的炎症反应为启动和维持CPSP的关键因素。
P2Y受体是一类以ATP、ADP等核苷酸分子为配体的G蛋白偶联,已经广泛应用于神经病理性疼痛的治疗研究[6]。研究[15-16]发现, P2Y受体共有8个亚型,其中P2Y12受体高选择性表达于小胶质细胞,为机体对伤害性信息进行整合和调节的重要位点。在坐骨神经结扎及化疗药物顺铂诱导的神经病理性疼痛模型中,脊髓小胶质细胞P2Y12受体表达均显著上调,提示P2Y12受体在神经病理性疼痛的形成和维持中发挥重要作用[8, 17]。本研究结果显示, P2Y12受体在CPSP小鼠组脑组织内表达上调,且只表达于小胶质细胞中,提示小胶质细胞P2Y12受体与CPSP的发生、发展密切相关。
TLR4是一种跨膜受体蛋白,在中枢神经系统内TLR4主要表达在小胶质细胞,当TLR4与相应配体结合后可激活下游的NF-κB信号通路引起炎性介质的大量释放,在神经炎症反应中发挥重要的调节作用[18]。在多种神经病理性疼痛动物模型中, TLR4/NF-κB信号通路在背根神经节、脊髓背角等神经组织中的表达水平明显上调,抑制TLR4/NF-κB信号通路的表达可有效缓解神经病理性疼痛[19-20]。此外, SUN N H等[21]研究发现,在异氟醚诱导的大鼠神经元损伤模型中,抑制P2Y12受体的激活可降低脑组织TLR4/NF-κB信号通路的表达水平,并改善神经元损伤。在本研究中, CPSP小鼠脑组织内TLR4和p-NF-κB p65表达上调,痛阈值降低。抑制P2Y12受体表达后, CPSP小鼠脑组织内TLR4和p-NF-κB p65表达下调,痛阈值提高,提示P2Y12受体可调控TLR4/NF-κB信号通路的表达。
综上所述,小胶质细胞P2Y12受体可能通过激活TLR4/NF-κB信号通路,参与小鼠丘脑出血后CPSP的形成。
-
表 1 4组小鼠不同时点热缩足潜伏期比较(x±s)
s 组别 T0 T1 T2 T3 C组 14.5±1.6 14.2±1.2 13.9±1.7 14.1±1.6 CPSP组 14.2±1.4 9.5±1.3* 7.9±0.9* 4.8±1.1* CPSP-M组 14.1±1.9 12.3±1.5*# 10.9±1.7*# 8.5±1.1*# C-M组 14.6±1.5 14.1±1.7 13.6±1.6 13.9±1.2 T0: 模型制备前1 d; T1: 造模后1 d; T2: 造模后3 d; T3: 造模后5 d。与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 表 2 4组小鼠不同时点冷缩足潜伏期比较(x±s)
s 组别 T0 T1 T2 T3 C组 19.1±2.1 20.4±2.2 18.3±3.6 18.7±2.4 CPSP组 19.5±2.1 14.8±2.7* 11.6±2.4* 7.5±1.6* CPSP-M组 19.9±3.4 17.6±2.3*# 14.2±2.2*# 11.6±1.5*# C-M组 19.7±2.9 20.6±2.8 18.5±2.3 18.7±2.8 与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 表 3 4组小鼠不同时点机械缩足反应频率比较(x±s)
% 组别 T0 T1 T2 T3 C组 12.5±8.9 11.3±8.3 12.5±10.4 13.8±7.4 CPSP组 11.3±8.3 43.8±9.2* 68.8±12.5* 88.8±14.6* CPSP-M组 12.5±7.1 33.8±5.2*# 47.5±8.9*# 57.5±14.9*# C-M组 13.8±7.4 12.5±7.1 13.8±10.6 16.3±7.4 与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 表 4 4组小鼠脑组织中P2Y12受体、TLR4和p-NF-κB p65表达比较(x±s, n=4)
组别 P2Y12/β-actin TLR4/β-actin p-NF-κB p65/NF-κB p65 C组 0.09±0.03 0.29±0.07 0.35±0.04 CPSP组 0.75±0.12* 1.12±0.23* 1.11±0.16* CPSP-M组 0.34±0.07*# 0.79±0.07*# 0.73±0.06*# C-M组 0.11±0.02 0.31±0.04 0.42±0.07 TLR4: Toll样受体4; p-NF-κB p65: 磷酸化核转录因子κB-p65。与C组比较, * P < 0.05; 与CPSP组比较, #P < 0.05。 -
[1] ZHENG B, YANG J, LI Y, et al. Pharmacotherapies for central post-stroke pain: a systematic review and network meta-analysis[J]. Oxid Med Cell Longev, 2022, 2022: 3511385.
[2] INFANTINO R, SCHIANO C, LUONGO L, et al. MED1/BDNF/TrkB pathway is involved in thalamic hemorrhage-induced pain and depression by regulating microglia[J]. Neurobiol Dis, 2022, 164: 105611.
[3] 贾可欣, 仲格嘉, 朱春燕, 等. 如意珍宝丸对小鼠丘脑出血后中枢痛的干预作用[J]. 中国实验方剂学杂志, 2022, 28(16): 82-89. [4] HUANG T F, FU G L, GAO J, et al. Fgr contributes to hemorrhage-induced thalamic pain by activating NF-κB/ERK1/2 pathways[J]. JCI Insight, 2020, 5(20): e139987.
[5] HUANG T F, LI Y, HU W Q, et al. Dexmedetomidine attenuates haemorrhage-induced thalamic pain by inhibiting the TLR4/NF-κB/ERK1/2 pathway in mice[J]. Inflammopharmacology, 2021, 29(6): 1751-1760.
[6] ZHANG X G, LI G L. P2Y receptors in neuropathic pain[J]. Pharmacol Biochem Behav, 2019, 186: 172788.
[7] MA B B, MONTGOMERY A P, CHEN B L, et al. Strategies for targeting the P2Y12 receptor in the central nervous system[J]. Bioorg Med Chem Lett, 2022, 71: 128837.
[8] SHI Y, WEN H Z, CUI J, et al. Ulinastatin inhibits microglia activation in spinal cord via P2Y12 receptor in a rat neuropathic pain model[J]. J Histotechnol, 2023, 46(1): 39-53.
[9] KUAN Y H, SHIH H C, TANG S C, et al. Targeting P(2)X(7) receptor for the treatment of central post-stroke pain in a rodent model[J]. Neurobiol Dis, 2015, 78: 134-145.
[10] 李航, 王泽颖, 王玉勇. 卒中后中枢性疼痛的中西医研究进展[J]. 湖南中医杂志, 2022, 38(10): 195-199. [11] 陶毅航. 星状/颈上神经节阻滞对大鼠出血性脑卒中后中枢痛的治疗作用及机制研究[D]. 延安: 延安大学, 2023. [12] WAN L, LI Z F, LIU T T, et al. Epoxyeicosatrienoic acids: emerging therapeutic agents for central post-stroke pain[J]. Pharmacol Res, 2020, 159: 104923.
[13] SAXENA S, KRUYS V, VAMECQ J, et al. The role of microglia in perioperative neuroinflammation and neurocognitive disorders[J]. Front Aging Neurosci, 2021, 13: 671499.
[14] LU H F, XU C Y, ZHANG L, et al. A new central post-stroke pain rat model: autologous blood injected thalamic hemorrhage involved increased expression of P2X4 receptor[J]. Neurosci Lett, 2018, 687: 124-130.
[15] 牛翻燕, 项文平, 薛慧, 等. 小胶质细胞和星形胶质细胞中的P2Y受体在中枢神经系统病变中的作用机制研究进展[J]. 中国实用神经疾病杂志, 2022, 25(3): 386-391. [16] 曾俊伟, 刘晓红, 蒋慧, 等. 脊髓背角P2Y12受体/P38MAPK参与MRS2395对CCI大鼠的镇痛作用[J]. 中国疼痛医学杂志, 2015, 21(1): 15-20, 27. [17] CHEN X T, CHEN L P, FAN L J, et al. Microglial P2Y12 signaling contributes to cisplatin-induced pain hypersensitivity via IL-18-mediated central sensitization in the spinal cord[J]. J Pain, 2023, 24(5): 901-917.
[18] ISLAM R, VRIONIS F, HANAFY K A. Microglial TLR4 is critical for neuronal injury and cognitive dysfunction in subarachnoid hemorrhage[J]. Neurocrit Care, 2022, 37(3): 761-769.
[19] CHANG S Q, LI X, ZHENG Y C, et al. Kaempferol exerts a neuroprotective effect to reduce neuropathic pain through TLR4/NF-κB signaling pathway[J]. Phytother Res, 2022, 36(4): 1678-1691.
[20] ZHAO Y X, YAO M J, LIU Q, et al. Electroacupuncture treatment attenuates paclitaxel-induced neuropathic pain in rats via inhibiting spinal Glia and the TLR4/NF-κB pathway[J]. J Pain Res, 2020, 13: 239-250.
[21] SUN N H, CHU L C, YUAN L, et al. Inactivation of P2YR12 contributes to isoflurane-induced neuronal injury by altering TLR-4/BDNF/TNF-Α[J]. Folia Neuropathol, 2019, 57(2): 161-169.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号