Correlations of serum tissue inhibitor of metalloproteinases-1, matrix metalloproteinase-9 and vascular endothelial growth factor with degree of myelofibrosis in patients with myeloproliferative neoplasms
-
摘要:目的
探讨骨髓增殖性肿瘤(MPN)患者血清血管内皮生长因子(VEGF)、基质金属蛋白酶-9(MMP-9)及金属蛋白酶抑制剂-1(TIMP-1)与骨髓纤维化(MF)分级的关系。
方法选择90例费城染色体阴性(Ph-)MPN初诊患者为MPN组。根据世界卫生组织(WHO)2016年骨髓纤维化分级标准将MPN患者分为纤维化前期或早期组54例和明显纤维化期组36例; 另选取健康志愿者50例作为对照组。采用酶联免疫吸附实验检测血清VEGF、MMP-9、TIMP-1水平并计算TIMP-1与MMP-9比值(TIMP-1/MMP-9)。采用Spearman秩相关检验分析VEGF、MMP-9、TIMP-1、TIMP-1/MMP-9与MF分级的相关性。绘制受试者工作特征(ROC)曲线分析各指标单独或联合诊断MPN或区分MF分级的预测价值。
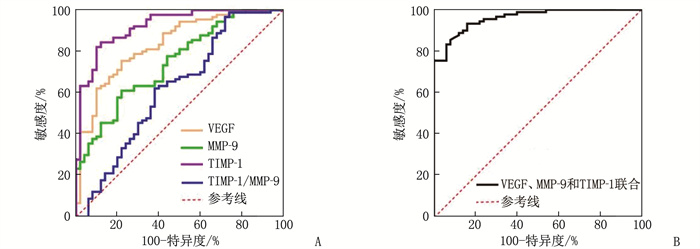
结果与对照组相比, MPN组血清VEGF、MMP-9和TIMP-1均升高,差异有统计学意义(P < 0, 05)。VEGF、MMP-9、TIMP-1、TIMP-1/MMP-9诊断MPN的曲线下面积(AUC)分别为0.834、0.745、0.923、0.618; VEGF、MMP-9和TIMP-1联合诊断MPN的AUC为0.960; 当最佳截断值为0.627时,敏感度为85.56%, 特异度为92.00%。与纤维化前期或早期组相比,明显纤维化期组患者血清VEGF、TIMP-1、TIMP-1/MMP-9均升高,差异有统计学意义(P < 0.05)。Spearman相关性分析结果显示, VEGF(r=0.378,P=0.001)、TIMP-1(r=0.512, P < 0.001)、TIMP-1/MMP-9(r=0.353, P=0.001)与MPN患者MF分级呈正相关(P < 0.05)。ROC曲线分析显示,VEGF、MMP-9、TIMP-1、TIMP-1/MMP-9区分纤维化前期或早期患者和明显纤维化期患者的AUC分别为0.723、0.523、0.802、0.708; VEGF、TIMP-1和TIMP-1/MMP-9联合区分纤维化前期或早期患者和明显纤维化期患者的AUC为0.838; 当最佳截断值为0.530时,敏感度为72.22%, 特异度为85.19%。
结论血清VEGF、TIMP-1和TIMP-1/MMP-9均可反映MPN患者MF进展,各指标联合检测可预测MPN患者MF程度。
Abstract:ObjectiveTo explore the correlations of serum vascular endothelial growth factor (VEGF), matrix metalloproteinase-9 (MMP-9) and tissue inhibitor of metalloproteinases-1 (TIMP-1) with grading of myelofibrosis (MF) in patients with myeloproliferative neoplasms (MPN).
MethodsNinety patients with Philadelphia chromosome negative (Ph-)MPN were selected as MPN group. According to the grading criteria for myelofibrosis by the World Health Organization (WHO) in 2016, MPN patients were divided into pre-fibrosis or early fibrosis group with 54 cases and significant fibrosis group with 36 cases; another 50 healthy volunteers were selected as the control group. Levels of serum VEGF, MMP-9 and TIMP-1 were detected by enzyme-linked immunosorbent assay, and the ratio of TIMP-1 to MMP-9 (TIMP-1/MMP-9) was calculated. Spearman rank correlation test was used to analyze the correlations of VEGF, MMP-9, TIMP-1 and TIMP-1/MMP-9 with MF grading. Receiver operating characteristic (ROC) curve was drawn to analyze the predictive value of each indicator alone or their combination for diagnosing MPN or distinguishing MF grading.
ResultsCompared with the control group, the serum levels of VEGF, MMP-9 and TIMP-1 in the MPN group increased significantly (P < 0.05). Values of area under the curve (AUC) of VEGF, MMP-9, TIMP-1 and TIMP-1/MMP-9 for diagnosing MPN were 0, 834, 0.745, 0.923 and 0.618 respectively; the AUC of the combined diagnosis of MPN by VEGF, MMP-9 and TIMP-1 was 0.960; when the optimal cut-off value was 0.627, the sensitivity was 85.56%, and the specificity was 92.00%. Compared with the pre-fibrosis or early fibrosis group, the serum levels of VEGF, TIMP-1 and TIMP-1/MMP-9 in the significant fibrosis group increased significantly (P < 0.05). Spearman correlation analysis showed that VEGF (r=0.378, P=0.001), TIMP-1 (r=0.512, P < 0.001) and TIMP-1/MMP-9 (r=0.353, P=0.001) were positively correlated with the MF grading of MPN patients (P < 0.05). ROC curve analysis showed that the values of AUC of VEGF, MMP-9, TIMP-1 and TIMP-1/MMP-9 for distinguishing patients with pre-fibrosis or early fibrosis from those with significant fibrosis were 0.723, 0.523, 0.802 and 0.708 respectively; the AUC of the combined detection of VEGF, TIMP-1 and TIMP-1/MMP-9 for distinguishing patients with pre-fibrosis or early fibrosis from those with significant fibrosis was 0.838; when the optimal cut-off value was 0.530, the sensitivity was 72.22%, and the specificity was 85.19%.
ConclusionSerum VEGF, TIMP-1 and TIMP-1/MMP-9 can reflect the MF progression of MPN patients, and the combined detection of these indicators can predict the MF degree of MPN patients.
-
丹参具有活血祛瘀、通经止痛、清心除烦和凉血消痈功效,其主要活性成分为丹参酮、丹参酚酸类化合物和挥发油等[1]。川芎活血行气,其主要活性成分包括阿魏酸、绿原酸、洋川芎内酯Ⅰ、阿魏酸松柏酯、迷迭香酸、洋川芎内酯A、阿魏酸松柏酯、藁本内酯等。川芎-丹参药对可活血行气,其中丹参活血而不伤血,川芎辛温香燥,走而不守,上行头目,下入血海,两者配伍可使活血化瘀、行气止痛之功倍增,为典型的相须配伍[2]。目前,参芎葡萄糖注射液、冠心宁注射液、冠心宁片等多种川芎-丹参配伍制剂已被用于临床疾病的治疗中。孙青[3]利用高效液相色谱法(HPLC)检测川芎-丹参药对不同配比的有效成分含量,发现合煎液中各成分提取率显著高于单煎液提取率。张聪等[4]利用中药方剂数据库计算川芎与其他中药配伍出现的频率,其中川芎-丹参药对居第1位。相关研究[5]表明,川芎-丹参配伍可治疗心肌梗死、阿尔茨海默病、动脉粥样硬化等疾病。近年来,基于网络药理学探讨中药复方作用机制的研究众多,中药复方的多层次多靶点网络可阐释药物的治病机理。本研究基于网络药理学研究方法分析川芎-丹参药对的活性成分、靶点和对疾病的作用机制,以期为临床合理使用川芎-丹参药对提供参考依据。
1. 材料与方法
1.1 成分和靶点的收集与筛选
在中药系统药理学分析平台(TCMSP)数据库(https://old.tcmsp-e.com/tcmsp.php)中搜索川芎和丹参的活性成分和作用靶点。药物经肝脏进入体循环血液中的药量占口服剂量的百分比称为口服生物利用度(OB), 是中药制剂研发过程中的关键药动学指标。类药性(DL)指活性成分与已知药物的相似性,是筛选药用成分的关键参数。通常OB值越高,活性成分的药用价值越高。中药药用成分筛选条件为OB≥30%, DL≥0.18[6-7]。
1.2 疾病数据收集和靶点对应基因获取
依照“1.1”方法筛选靶点,检索TCMSP数据库中与其对应的疾病,通过Uniprot网站(https://www.uniprot.org/) 的UniprotKB数据库获取靶点相应基因,以Excel格式导出,使用VLOOKUP函数将靶点与基因信息一一对应[8]。
1.3 多层次多靶点网络的构建
使用Cytoscape 3.9.1软件将已收集的川芎和丹参的活性成分、靶点和疾病整合后,构建“药物-成分-靶点-疾病”网络[9]。构建的网络中,点和线的颜色、粗细均可赋值表示相应指标,如圆圈的大小和颜色表示药物-成分-靶点-疾病的连通性和权重高低。Degree表示某一节点与其他节点连接边的数量。Cytoscape网络分析常以Degree值高作为筛选参数,川芎-丹参药对的网络构建亦参考此方法,即筛选Degree值高的关键参数,构建川芎-丹参“药物-成分-靶点-疾病”网络,并探讨川芎-丹参药对的作用机制。
1.4 基因本体论(GO)和京都基因与基因组百科全书(KEGG)通路富集分析
利用GO基因功能注释分析和KEGG通路富集分析方法分析川芎-丹参药对的作用机制。在DAVID数据库(https://david.ncifcrf.gov/)中导入整理好的靶点基因,选择与靶点基因名称对应的选项,点击"Homo Sapiens", 提交基因列表。数据处理后,导出生物过程、分子功能、细胞成分和KEGG通路数据,设定阈值P < 0.05, 绘图[10-12]。
1.5 川芎-丹参药对指纹图谱研究
1.5.1 溶液制备
取15批药材(每批药材为丹参、川芎各5 g), 分别置于锥形瓶中,加100 mL水浸泡1 h后,回流提取2.5 h, 抽滤后得丹参-川芎合煎液,加入70%乙醇稀释后得到供试品溶液。
1.5.2 混合对照品溶液制备
取谷甾醇、川芎嗪、丹参醇B、鼠尾草酚酮、木犀草素、川芎哚对照品,加70%乙醇制成混合对照品溶液。
1.5.3 色谱条件
使用Agilent XDB C18色谱柱(150 mm×4.6 mm, 5 μm), 流动相为乙腈(A)-水(B), 梯度洗脱(0~35 min、17%~28% A, 35~50 min、28%~75% A, 50~60 min、75%~80% A), 流速1.0 mL/min, 检测波长280 nm, 柱温20 ℃, 进样量20 μL。
2. 结果
2.1 川芎-丹参药对的活性成分筛选
搜索TCMSP数据库发现川芎-丹参药对的活性成分324个(川芎175个,丹参149个),根据条件(OB≥30%, DL≥0.18)筛选后共得到15个主要活性成分,见表 1。
表 1 川芎-丹参药对中15个活性成分信息编号 活性成分 分子式 生物利用度/% 类药性 CX-1 谷甾醇(sitosterol) C29H50O 35.32 0.72 CX-2 杨梅黄酮(myricanone) C21H24O5 45.60 0.51 CX-3 亚油酸乙酯(mandenol) C20H36O2 42.00 0.45 CX-4 川芎萘呋内(wallichilide) C25H32O5 48.21 0.26 CX-5 洋川芎醌(senkyunone) C22H30O2 56.37 0.53 CX-6 川芎哚(perlolyrine) C16H12N2O2 35.15 0.56 CX-7 叶酸(FA) C19H19N7O6 66.92 0.62 CX-8 川芎嗪(tetramethylpyrazine) C8H12N2 30.03 0.33 DS-1 异欧前胡素(Isoimperatorin) C16H14O4 54.27 0.36 DS-2 丹参醇B(Danshenol B) C22H26O4 68.32 0.64 DS-3 二氢丹参酮Ⅰ(Dihydrotanshinone Ⅰ) C18H12O3 48.32 0.32 DS-4 丹酚酸G(S川芎哚alvianolic acid g) C26H22O10 45.37 0.55 DS-5 鼠尾草酚酮(Salviolone) C18H20O2 39.62 0.57 DS-6 紫丹参素C(Przewaquinone C) C18H16O4 37.61 0.73 DS-7 木犀草素(Luteolin) C15H10O6 43.82 0.52 2.2 多层次多靶点网络的构建与分析
川芎-丹参药对的“药物-成分-靶点-疾病”网络图含有259个节点(2种药物, 15个成分, 72个靶点,187种疾病)和453条边线。以Degree≥10为条件筛选关键活性成分和靶点,以Degree≥5为条件筛选疾病。筛选结果显示, Degree≥10的活性成分有谷甾醇(编号CX-1)、丹参醇B(编号DS-2)、川芎嗪(编号CX-8)、木犀草素(编号DS-7)、鼠尾草酚酮(编号DS-5), 其Degree值分别为43、36、32、29、22, 说明这5个活性成分是构建网络中关键活性成分,在川芎-丹参药对的药理作用中具有功效; Degree≥10的靶标蛋白有10个,包括醛糖还原酶(AKR1B1)、碳酸酐酶2(CA2)、碳酸酐酶1(CA1)、乙醛脱氢酶2(ALDH2)、前列腺素G/H合成酶1(PTGS1)、表皮生长因子受体(EGFR)、基质金属蛋白酶9(MMP9)、基质金属蛋白酶2(MMP2)、去甲肾上腺素转运体(SLC6A2)和腺苷受体A1(ADORA1),以上靶标蛋白中Degree最高的为AKR1B1,表明川芎-丹参药对可以调节其表达,对机体产生作用; Degree≥5的疾病有8种,包括疼痛、心血管疾病、阿尔茨海默病、前列腺癌、脑损伤、炎症、焦虑症、精神分裂症,其中Degree最高的为心血管疾病,这与川芎-丹参药对主要治疗心血管疾病相吻合。见表 2。
表 2 “药物-成分-靶点-疾病”网络节点及参数类型 名称 Degree 中介中心度 活性成分 谷甾醇 43 0.332 8 活性成分 丹参醇B 36 0.193 8 活性成分 川芎嗪 32 0.300 2 活性成分 木犀草素 29 0.037 2 活性成分 鼠尾草酚酮 22 0.097 4 靶点 醛糖还原酶 38 0.251 3 靶点 碳酸酐酶2 34 0.097 3 靶点 碳酸酐酶1 31 0.076 2 靶点 乙醛脱氢酶2 25 0.076 2 靶点 前列腺素G/H合成酶1 24 0.073 2 靶点 表皮生长因子受体 20 0.058 2 靶点 基质金属蛋白酶9 19 0.063 2 靶点 基质金属蛋白酶2 14 0.054 4 靶点 去甲肾上腺素转运体 13 0.033 9 靶点 腺苷受体A1 12 0.046 8 疾病 疼痛 8 0.022 4 疾病 心血管疾病 6 0.032 5 疾病 阿尔茨海默病 7 0.020 3 疾病 前列腺癌 7 0.004 4 疾病 脑损伤 5 0.007 3 疾病 炎症 5 0.011 6 疾病 焦虑症 5 0.008 7 疾病 精神分裂症 5 0.003 2 2.3 GO富集分析结果
利用DAVID 6.8数据库,以P < 0.05且人类物种为条件进行GO功能富集分析。GO富集分析共得到条目223条: 生物过程165条,包括对药物的反应、增殖过程的正调控、转录的正调控和DNA模板化、Erk1和Erk2级联的正调控、缺氧反应等; 分子功能30条,包括序列特异性DNA结合、转录调节区DNA结合、药物结合、蛋白酶结合和细胞因子活性等; 细胞组成28条,包括质膜、含胶原的细胞外基质、质膜组成部分、膜区、细胞表面等。GO富集分析的主要结果见图 1、表 3。
表 3 川芎-当归药对相应基因GO富集分析结果(各类型前5条条目)GO生物学过程注释 类型 基因 对药物的反应 生物过程 JUN, HSP90AAI, TGFBI, MAOB, HTR2A, PTG2, SLC6A2, ADRAIA 增殖过程的正调控 生物过程 NCOAJ, CASP9, F7, TGFBJ, CASP8, CASP3, PTG92, ESRJ, SLC6A4 转录的正调控, DNA模板化 生物过程 ADRBJ, ADRB2, ADRAJB, ADRAJA, ADRA2B, ADRA2A Erk1和Erk2级联的正调控 生物过程 CHRM2, CHRM3, CHRMJ, CHRNA2, CHRNA7, CHRM4 缺氧反应 生物过程 CHRNA7, MAPK14, NR3Cl, ESRJ, ADRAJA, ESR2, ADRA2A, NR3C2, AR, PLAU, PGR, PPARG 质膜 细胞组成 GABRB3, CHRM2, CHRM3, GiK3B, CHRMJ, CHRNA2, CHRM4, CHRNA7 含胶原的细胞外基质 细胞组成 GABRB3, CHRM2, CHRM3, GiK3B, CHRMJ, CHRNA2, CHRM4, CHRNA7 质膜组成部分 细胞组成 ADRBJ, ADRB2, HTR2A, OPRMJ, ADRAJB, SLC6A2, ADRAJA, ADRA2B, SLC6A3, ADRA2A, SLC6A4, KDR, DRDJ 膜区 细胞组成 NCOA1, HSP90AA1, CASP8, MAP2, 0PRM1, PTG-92, SLC6A2, SLC6A3, SLC6A4 细胞表面 细胞组成 GABRB3, CHRM2, GABRA2, GABRA1, CHRM3, CHRMJ, GABRAS, CHRM4 序列特意性DNA结合 分子功能 AR, RXRA, PGR, PPARG, NR3C1, ESRJ, ESR2, NR3C2 转录调节区DNA结合 分子功能 NCOAJ, JUN, TGFBJ, PRKCA, PTG 92, MAPK14, ESRJ, ESR2, AR, RXRA, PGR, PPARG, SCNSA 药物结合 分子功能 CHRM2, GABRAJ, CHRM3, CHRMJ, CHRNA2, PPARG, HTR2A, SLC6A3 蛋白酶结合 分子功能 AR, PGR, NR3Cl, ESRJ, ESR2, NR3C2 细胞因子活性 分子功能 GABRB3, GABRA2, GABRAJ, CHRNA2, GABRA5, CHRNA7 2.4 KEGG通路富集分析结果
利用DAVID 6.8数据库进行KEGG通路富集分析,共得到78条信号通路,包括癌症通路、神经活性配体-受体相互作用、PI3K-Akt信号通路、乙肝信号通路、癌症中的蛋白多糖等。KEGG通路富集分析的主要结果见图 2、表 4。
表 4 川芎-当归药对相应基因KEGG富集分析结果(前16条通路)KEGG通路 错误发现率 基因 癌症的通路 1.99×10-11 GABRB3, CHRM2, GABRA2, CHRM3, GABRAJ, CHRMJ, CHRNA2, GA 神经活性配体-受体相互作用 2.13×10-9 CHRM2, CHRM3, CHRMl, NOS2, NOS3, CHRNA7, F2R, PRKCA, ADRB1 PI3K-Akt信号通路 2.51×10-7 GSK3B, JUN, HSP90, TGFB1, NOS2, F2R, PRKCA, PTGS2, PIK3CG 乙肝信号通路 1.37×10-5 GABRB3, MAOB, MAOA, CSP3, PRKCA, HFt2A, PRKACA, PIfGS2 癌症中的蛋白多糖 1.37×10-3 CASP9, CCNA2, JUN, CfGFB1, CSP8, CASP3, CDK2, BCL2, BAX, PRKCA, PIK3CG HIF-1信号通路 2.31×10-5 CASP9, GSK3B, JUN, CfGFB1, CASP3, BCL2, BAX, PIK3CG 肿瘤坏死因子信号通路 2.31×10-6 GABRA2, GABRA1, GABRA3, PDE3A, PRKCA, DRD1, OPRM1, PRKACA 弓形虫病 2.69×10-5 JUN, MAOB, MAOA, CALM3, PRKCA, DRD1, PRKACA, SLC6AJ 雌激素信号通路 2.79×10-9 HSP90JUN, NOS3, CALM3, OPRMl, PRKACA, ESRl, ESR2, PIK3CG T细胞受体信号通路 3.83×10-4 BCL2, CALM3, ADRBJ, PRKCA, ADRB2, SCNSA, ADRAJB, MAPK14, PRKACA, ADRAJA 大肠癌 6.61×10-7 CHRM2, CHRM3, CHRM1, CHRNA7, CHRM4, BCL2, PRKCA, PRKACA, PIK3CG 百日咳 7.89×10-6 NCOA1, CALW9, NCOA2, GSKJB, RXRA, PRKCA, PRKACA, ESR1, PIKJCG 恰加斯病 8.91×10-7 CHRM2, JUN, CHRMJ, F2R, PDE3A, CALM3, ADRB1, DRD1, ADRB2, PRKACA, PIK3CG 5-羟色胺能突触 9.20×10-8 CHRM3, CALM3, ADRB1, PRKCA, ADRB2, ADRB3, PRKACA, ADRA1A 胰腺癌 1.27×10-7 CASP9, NOS3, KDR, PRKCA, MAPK14, PrGS2, PIX3CG 催乳素信号通路 1.30×10-4 GSK3B, MAOB, MAOA, CALM3, PRKCA, DRDJ, MAPK14, PRKACA, SLC6A3 2.5 川芎-丹参药对指纹图谱的建立
分别取15批川芎-丹参饮片(S1~S15), 制备供试品溶液并分别进样,记录色谱图,导入中药色谱指纹图谱相似度评价系统(2012版)中,设置时间窗宽度为0.3, 采用中位数法,进行色谱峰匹配,生成对照图谱,共标定11个共有峰,得到川芎-丹参药对指纹图谱,见图 3。与混合对照品溶液色谱图相比,色谱图标定谷甾醇、川芎嗪、丹参醇B、鼠尾草酚酮、木犀草素、川芎哚这6个色谱峰,见图 4。15批川芎-丹参药对指纹图谱相似度分别为0.999、0.998、1.000、1.000、1.000、0.999、0.999、0.998、0.999、1.000、0.999、1.000、0.997、0.999、1.000,提示15批饮片均质量稳定。
3. 讨论
本研究基于网络药理学研究方法,通过TCMSP和DAVID 6.8数据库分析川芎-丹参药对的活性成分、靶标蛋白和疾病,并对靶点基因进行GO和KEGG富集分析,发现川芎-丹参药对有72个靶点, 2种药物的15种活性成分参与调节靶标基因的生物学过程、细胞功能和分子组成,从而达到治疗相关疾病的药理作用。
“药物-成分-靶点-疾病”网络图中,川芎和丹参中Degree值排名前2位的活性成分分别为谷甾醇和丹参醇B, HPLC指纹图谱检测表明谷甾醇和丹参醇B为川芎和丹参中的活性成分。裴浩等[13]发现,谷甾醇可以抑制口腔鳞状细胞癌增殖。陈颖[14]通过微量稀释法发现丹参醇B具有抗菌抑菌作用,与头孢噻肟联用抑菌效果可提高6倍。本研究发现,靶标蛋白AKR1B1、CA2、CA1、ALDH2、PTGS1、EGFR、MMP9、MMP2、SLC6A2和ADORA1的Degree值高于10, 说明以上靶标蛋白作为关键靶点参与调控疾病信号通路。疼痛等疾病的靶点AKR1B1、CA2与细胞凋亡和心肌纤维化等信号转录因子相关度较高,说明这2个靶标蛋白参与川芎-丹参治疗疾病的免疫反应过程。王倩婷等[15]研究了AKR1B1对乳腺癌患者MCF-7细胞的调节机制,发现AKR1B1能有效抑制细胞凋亡现象。
GO富集分析和KEGG富集分析结果表明,大部分靶标蛋白富集在增殖过程的正调控、Erk1和Erk2级联的正调控生物学过程, Erk1和Erk2为细胞外信号调节激酶的成员,参与调控细胞分化和细胞凋亡过程,可促进细胞增殖,在多种肿瘤中异常表达[16-17],推测抗癌可能是川芎-丹参药对的重要药理作用之一。
综上所述,川芎-丹参药对治疗疼痛、炎症、癌症等多种疾病与AKR1B1、CA2、CA1、ALDH2等靶点有关,也与癌症信号通路、PI3K-Akt信号通路和神经活性配体-受体相互作用信号通路等有关,故推测川芎-丹参药对中的活性成分通过参与调控关键通路中的关键靶标基因表达而达到治疗疾病的目的。本研究基于网络药理学方法挖掘川芎-丹参药对的“药物-成分-靶点-疾病”网络关系,进行GO和KEGG通路富集分析,有助于从基因和细胞组成层面揭示川芎-丹参药对治疗疾病的机制,进而为临床应用川芎-丹参复方提供借鉴。
-
表 1 对照组与MPN组血清VEGF、MMP-9、TIMP-1、TIMP-1/MMP-9比较(x±s)
组别 n VEGF/(pg/mL) MMP-9/(pg/mL) TIMP-1/(pg/mL) TIMP-1/MMP-9 对照组 50 201.16±73.48 346.28±107.84 358.66±83.25 1.21±0.72 MPN组 90 297.74±71.67* 449.01±103.09* 540.28±96.43* 1.27±0.39 MPN: 骨髓增生性肿瘤; VEGF: 血管内皮生长因子; MMP-9: 基质金属蛋白酶-9; TIMP-1: 金属蛋白酶抑制剂-1;
TIMP-1/MMP-9: 金属蛋白酶抑制剂-1与基质金属蛋白酶-9比值。与对照组比较, * P < 0.05。表 2 血清VEGF、MMP-9、TIMP-1、TIMP-1/MMP-9诊断MPN的价值
指标 曲线下面积 95%CI Youden指数 最佳截断值 P 敏感度/% 特异度/% VEGF 0.834 0.765~0.903 0.536 246.34 pg/mL < 0.001 75.56 78.00 MMP-9 0.745 0.663~0.827 0.391 422.22 pg/mL < 0.001 61.11 78.00 TIMP-1 0.923 0.878~0.968 0.923 455.04 pg/mL < 0.001 84.44 88.00 TIMP-1/MMP-9 0.618 0.516~0.720 0.249 0.773 0.024 98.89 26.00 3项联合 0.960 0.913~0.986 0.776 0.627 < 0.001 85.56 92.00 表 3 不同MF分级患者血清VEGF、MMP-9、TIMP-1、TIMP-1/MMP-9比较(x±s)
组别 n VEGF/(pg/mL) MMP-9/(pg/mL) TIMP-1/(pg/mL) TIMP-1/MMP-9 纤维化前期或早期组 54 231.70±69.93 497.99±102.45 384.55±72.67 0.80±0.23 明显纤维化期组 36 284.29±62.83* 505.54±105.33 486.38±96.17* 1.01±0.30* 与纤维化前期或早期组比较, * P < 0.05。 表 4 血清VEGF、MMP-9、TIMP-1、TIMP-1/MMP-9区分MF分级的价值
指标 曲线下面积 95%CI Youden指数 最佳截断值 P 敏感度/% 特异度/% VEGF 0.723 0.614~0.832 0.454 258.11 pg/mL < 0.001 69.44 75.93 MMP-9 0.523 0.399~0.647 0.139 542.94 pg/mL 0.716 41.67 72.22 TIMP-1 0.802 0.701~0.903 0.537 448.07 pg/mL < 0.001 66.67 87.04 TIMP-1/MMP-9 0.708 0.597~0.819 0.398 0.854 < 0.001 69.44 70.37 3项联合 0.838 0.745~0.907 0.574 0.530 < 0.001 72.22 85.19 -
[1] GODFREY A L. Myeloproliferative neoplasms (MPNs)[J]. Blood Rev, 2020, 42: 100717. doi: 10.1016/j.blre.2020.100717
[2] SHAHIN O A, CHIFOTIDES H T, BOSE P, et al. Accelerated phase of myeloproliferative neoplasms[J]. Acta Haematol, 2021, 144(5): 484-499. doi: 10.1159/000512929
[3] PRAKASH S, ARBER D A, BUESO-RAMOS C, et al. Advances in myelodysplastic/myeloproliferative neoplasms[J]. Virchows Arch, 2023, 482(1): 69-83. doi: 10.1007/s00428-022-03465-7
[4] EL-SHARKAWY F, MARGOLSKEE E. Pediatric myeloproliferative neoplasms[J]. Clin Lab Med, 2021, 41(3): 529-540. doi: 10.1016/j.cll.2021.04.010
[5] GANGAT N, TEFFERI A. Myelofibrosis biology and contemporary management[J]. Br J Haematol, 2020, 191(2): 152-170. doi: 10.1111/bjh.16576
[6] GREENFIELD G, MCMULLIN M F, MILLS K. Molecular pathogenesis of the myeloproliferative neoplasms[J]. J Hematol Oncol, 2021, 14(1): 103. doi: 10.1186/s13045-021-01116-z
[7] AHMAD A, NAWAZ M I. Molecular mechanism of VEGF and its role in pathological angiogenesis[J]. J Cell Biochem, 2022, 123(12): 1938-1965. doi: 10.1002/jcb.30344
[8] TEFFERI A. Primary myelofibrosis: 2021 update on diagnosis, risk-stratification and management[J]. Am J Hematol, 2021, 96(1): 145-162. doi: 10.1002/ajh.26050
[9] RAJA V, FARAJZADEGAN Z, MANSOURIAN M, et al. Diagnostic value of nonacid nucleic blood tumor marker panels in early diagnosing breast cancer: a systematic review and network meta-analysis[J]. Dis Markers, 2022, 2022: 4119345.
[10] MARIA A T J, BOURGIER C, MARTINAUD C, et al. From fibrogenesis towards fibrosis: Pathophysiological mechanisms and clinical presentations[J]. Rev Med Interne, 2020, 41(5): 325-329. doi: 10.1016/j.revmed.2020.01.002
[11] HENDERSON N C, RIEDER F, WYNN T A. Fibrosis: from mechanisms to medicines[J]. Nature, 2020, 587(7835): 555-566. doi: 10.1038/s41586-020-2938-9
[12] ARBER DA, ORAZI A, HASSERJIAN R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016; 127(20): 2391-2405[J]. Blood, 2016, 128(3): 462-463.
[13] MORSIA E, GANGAT N. Myeloproliferative neoplasms with monocytosis[J]. Curr Hematol Malig Rep, 2022, 17(1): 46-51. doi: 10.1007/s11899-021-00660-2
[14] BARBUI T, THIELE J, GISSLINGER H, et al. The 2016 WHO classification and diagnostic criteria for myeloproliferative neoplasms: document summary and in-depth discussion[J]. Blood Cancer J, 2018, 8(2): 15. doi: 10.1038/s41408-018-0054-y
[15] 聂子元, 罗建民. 《原发性骨髓纤维化诊断与治疗中国指南(2019年版)》解读: 原发性骨髓纤维化从指南到实践[J]. 河北医科大学学报, 2019, 40(7): 745-748, 752. doi: 10.3969/j.issn.1007-3205.2019.07.001 [16] 高晓冬, 张志南, 宋燕, 等. JAK2V617F基因突变与骨髓增殖性肿瘤类型及疾病转化的相关性分析[J]. 哈尔滨医科大学学报, 2015, 49(3): 236-238. https://www.cnki.com.cn/Article/CJFDTOTAL-HYDX201503012.htm [17] FERRARI A, SCANDURA J, MASCIULLI A, et al. Prevalence and risk factors for Pulmonary Hypertension associated with chronic Myeloproliferative Neoplasms[J]. Eur J Haematol, 2021, 106(2): 250-259. doi: 10.1111/ejh.13543
[18] LEE Y C, HSIEH C C, LEE Y L, et al. Molecular markers and prognosis of myelofibrosis in the genomic era: a meta-analysis[J]. Clin Lymphoma Myeloma Leuk, 2018, 18(9): 558-568. doi: 10.1016/j.clml.2018.06.004
[19] SUBOTICKI T, MITROVICAJTICO, ŽIVKOVICE, et al. VEGF regulation of angiogenic factors via inflammatory signaling in myeloproliferative neoplasms[J]. Int J Mol Sci, 2021, 22(13): 6671. doi: 10.3390/ijms22136671
[20] GADOMSKA G, STANKOWSKA K, BOINSKA J, et al. VEGF-A, sVEGFR-1, and sVEGFR-2 in BCR-ABL negative myeloproliferative neoplasms[J]. Medicina, 2017, 53(1): 34-39. doi: 10.1016/j.medici.2017.01.004
[21] HUANG H. Matrix metalloproteinase-9 (MMP-9) as a cancer biomarker and MMP-9 biosensors: recent advances[J]. Sensors, 2018, 18(10): 3249. doi: 10.3390/s18103249
[22] GOBIN E, BAGWELL K, WAGNER J, et al. A pan-cancer perspective of matrix metalloproteases (MMP) gene expression profile and their diagnostic/prognostic potential[J]. BMC Cancer, 2019, 19(1): 581. doi: 10.1186/s12885-019-5768-0
[23] WANG J C. Importance of plasma matrix metalloproteinases (MMP) and tissue inhibitors of metalloproteinase (TIMP) in development of fibrosis in agnogenic myeloid metaplasia[J]. Leuk Lymphoma, 2005, 46(9): 1261-1268. doi: 10.1080/10428190500126463
[24] CHAUDHARY A K, CHAUDHARY S, GHOSH K, et al. Secretion and expression of matrix metalloproteinase-2 and 9 from bone marrow mononuclear cells in myelodysplastic syndrome and acute myeloid leukemia[J]. Asian Pac J Cancer Prev, 2016, 17(3): 1519-1529. doi: 10.7314/APJCP.2016.17.3.1519
[25] MURATE T, YAMASHITA K, ISOGAI C, et al. The production of tissue inhibitors of metalloproteinases (TIMPs) in megakaryopoiesis: possible role of platelet- and megakaryocyte-derived TIMPs in bone marrow fibrosis[J]. Br J Haematol, 1997, 99(1): 181-189. doi: 10.1046/j.1365-2141.1997.3293146.x
[26] 陈禾惠, 王冲, 陈朴, 等. 血清LDH、TIMP1、BLC、Eotaxin2预测骨髓增殖性肿瘤患者骨髓纤维化程度的效能[J]. 临床检验杂志, 2023, 41(3): 204-207. https://www.cnki.com.cn/Article/CJFDTOTAL-LCJY202303010.htm -
期刊类型引用(17)
1. 迟欣如,陈正伟,李捷,吴爱英,尹丽华,刘红兵,卢京光. 益心复脉颗粒HPLC特征图谱建立及9种成分含量测定. 中成药. 2025(01): 1-6 .  百度学术
百度学术
2. 耿瑜,何玉梅,王芳. 通过HIF-1α/NLRP3信号通路探讨血府逐瘀胶囊治疗急性脑梗死的作用机制. 辽宁中医杂志. 2025(01): 59-62 .  百度学术
百度学术
3. 朱瑛,曹守沛. 曹守沛从脾胃论治冠心病经验. 河南中医. 2025(02): 244-249 .  百度学术
百度学术
4. 杨方成,金华,邵贵峰,汪茂宝. 祛热逐湿清毒加减方联合卡格列净治疗湿热证糖尿病肾病患者的临床观察. 世界中西医结合杂志. 2025(01): 175-180 .  百度学术
百度学术
5. 舒鹏钦,陈铁龙,刘昭. 益气活血通冠汤对冠心病心绞痛患者血液流变学、心电图及外周血microRNA-155、VASP表达的影响. 中国基层医药. 2025(02): 166-171 .  百度学术
百度学术
6. 林燕,陈芳,郭风媛,熊燕. 调冲汤加减结合保胎贴穴位贴敷治疗对复发性流产妇女妊娠结局的影响. 中国医药指南. 2025(08): 145-147 .  百度学术
百度学术
7. 肖旭. 丹参川芎嗪联合醋酸奥曲肽治疗急性胰腺炎的疗效观察. 大医生. 2024(08): 82-84 .  百度学术
百度学术
8. 陶春德,冯玉沛,谢卓霖. 益气活络明目汤联合康柏西普眼用注射液对非增殖期糖尿病视网膜病变患者的临床疗效. 中成药. 2024(07): 2230-2234 .  百度学术
百度学术
9. 胡峻瑞,刘燕平,梁韡斌. 针刺联合通痹益脑汤治疗老年后循环缺血性孤立性眩晕的临床研究. 国际中医中药杂志. 2024(07): 854-859 .  百度学术
百度学术
10. 陈婷,刘伟,黄菲. 基于络病理论探讨益气养阴通络法治疗糖尿病肾脏病. 河南中医. 2024(08): 1173-1177 .  百度学术
百度学术
11. 白佳佳. 中医药促醒治疗的研究进展. 大医生. 2024(14): 14-18 .  百度学术
百度学术
12. 楚家豪,张瑞坤,张杨,陈海峰,吴海帆,蒋逸,陈铁武,姚新苗. 万应消痛膏治疗寒湿痹阻型膝骨关节炎的疗效观察. 浙江临床医学. 2024(06): 828-830 .  百度学术
百度学术
13. 刘辉,张恒,陶叶琴,聂格,欧阳文. 基于指纹图谱和网络药理学预测丹楂通脉丸药效物质基础. 湖南中医药大学学报. 2024(08): 1373-1384 .  百度学术
百度学术
14. 俞鹏飞,薛凯元,林立,杨婧雯,安月鹏,袁锐,王姗姗,杨素清. 基于网络药理学及分子对接分析当归-川芎药对治疗银屑病的作用机制. 中国医院用药评价与分析. 2024(08): 910-914 .  百度学术
百度学术
15. 黄宜平. 四君子汤加减辅助治疗慢性胃炎患者的效果. 中外医学研究. 2024(24): 13-16 .  百度学术
百度学术
16. 李培培,高宗跃,左振魁,刘天天,尚雅嵩,周晓丽. 回阳生肌膏联合益气活血生肌方对Ⅱ~Ⅲ度痔痔注射术后患者的临床疗效. 中成药. 2024(11): 3882-3885 .  百度学术
百度学术
17. 惠飞,张志伟,刘涛,李赞. 活血跌打促愈方联合骨肽片对SandersⅡ、Ⅲ型跟骨骨折患者术后骨折愈合的影响. 河南医学研究. 2024(21): 3975-3979 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载:





 苏公网安备 32100302010246号
苏公网安备 32100302010246号