Cephalometric study of facial morphology and hyoid bone position in children with obstructive sleep apnea syndrome
-
摘要:目的
分析阻塞性睡眠呼吸暂停综合征(OSAS)患儿面部形态和舌骨位置的头影测量指标结果。
方法随机选取78例OSAS患儿纳入OSAS组, 另选取未接受过耳鼻喉科、正畸或语言治疗的78名健康体检儿童纳入健康对照组。2组儿童均接受耳鼻喉科评估和头影测量,且OSAS组患儿接受夜间多导睡眠描记(PSG)检查。
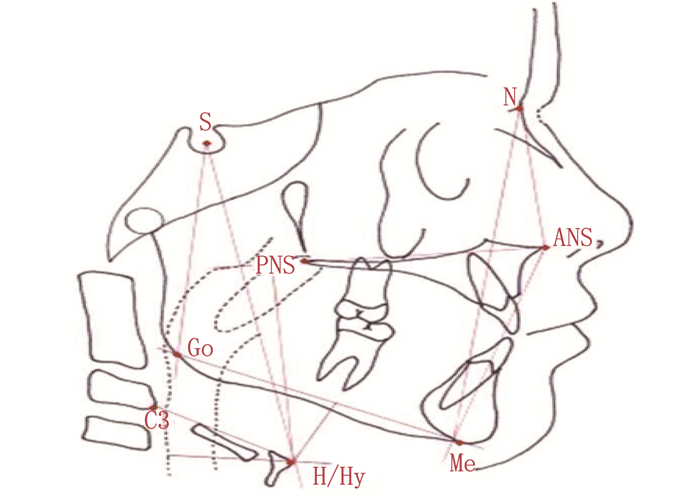
结果面部头影测量结果显示, OSAS组面部前高度(N-Me)、面部前下高度(ANS-Me)均高于健康对照组,差异有统计学意义(P<0.05); OSAS组面部上前高度(N-ANS)、面部后部总高度(S-Go)与健康对照组比较,差异无统计学意义(P>0.05)。舌骨测量结果显示, OSAS组舌骨点至下颌平面的垂直距离(HyS)、舌骨体之最前上方至第三颈椎之最前下点的线性距离(C3-H)、舌骨最前点(Dh-H)、舌骨最前点至腭平面的垂直距离(HyMP)、舌骨最后点(Dv-H)均大于健康对照组,差异有统计学意义(P<0.05)。
结论相较于健康儿童, OSAS患儿面部生长发育存在明显变化,表现为N-Me和ANS-Me增加, HyS、C3-H、HyMP、Dh-H、Dv-H增加。
-
关键词:
- 阻塞性睡眠呼吸暂停综合征 /
- 面部形态 /
- 舌骨位置 /
- 头影测量 /
- 多导睡眠描记
Abstract:ObjectiveTo analyze the results of cephalometric indicators of facial morphology and hyoid bone position in children with obstructive sleep apnea syndrome (OSAS).
MethodsA total of 78 children with OSAS were randomly selected and included in OSAS group. Another 78 healthy children who had not received otolaryngology, orthodontics or speech therapy were selected as healthy control group. Children in both groups underwent otolaryngology evaluation and cephalometric measurement, and the OSAS group also underwent overnight polysomnography (PSG) examination.
ResultsThe cephalometric measurement results of the facial shape showed that the facial anterior height (N-Me) and facial anterior inferior height (ANS-Me) in the OSAS group were higher than those in the healthy control group (P < 0.05). There were no significant differences in the facial anterior superior height (N-ANS) and facial posterior total height (S-Go) between the OSAS group and the healthy control group (P>0.05). The hyoid bone measurement results showed that the vertical distance from the hyoid bone point to the mandibular plane (HyS), the linear distance from the most anterior superior point of the hyoid bone to the most inferior point of the third cervical vertebra (C3-H), the anterior point of the hyoid bone (Dh-H), the vertical distance from the most anterior point of the hyoid bone to the palatal plane (HyMP), and the most posterior point of the hyoid bone (Dv-H)in the OSAS group were all greater than those in the healthy control group (P < 0.05).
ConclusionCompared with healthy children, there are significant changes in facial growth and development in children with OSAS, which are characterized by increased N-Me and ANS-Me, as well as increased HyS, C3-H, HyMP, Dh-H, and Dv-H.
-
肺结核是一种由结核分枝杆菌感染引起的慢性传染病,由于其发病率、传染率高,被称为世界上最致命的传染病杀手[1-2]。近年来,受到免疫缺陷病毒感染和耐药菌株增加的影响,肺结核的防治遇到了很多困难[3]。若1个或多个器官和组织发生衰竭,患者疾病会进展为重症肺结核,诱发大咳血等一系列并发症,极大威胁患者生命健康[4]。血清应激诱导蛋白2(Sestrin2)是Sestrin家族的重要成员,是一组维持氧化还原稳态所需的应激诱导蛋白,是抗氧化体系的重要成员,在机体缺氧、遗传物质损伤、氧化应激和内质网应激等情况下, Sestrin2的表达上调[5]。Sestrin2在细胞里可以与很多信号通路相互作用,调节细胞相关生物学功能能够防止其被氧化应激影响,且该蛋白和肝脏、心血管、呼吸系统等疾病的发病关系十分密切[6]。血清胎球蛋白A(Fetuin-A)是一种多功能蛋白,属于内源性抑制剂,可减少胰岛素受体酪氨酸激酶的分泌,在脂质代谢中具有促炎作用,诱导炎症反应[7]。但是关于血清Sestrin2、Fetuin-A水平与重症肺结核患者疾病转归关系的报道较少。本研究探讨血清Sestrin2、Fetuin-A水平变化与重症肺结核患者疾病转归的关系。
1. 资料与方法
1.1 一般资料
选取2020年12月—2022年12月收治的108例重症肺结核患者为研究对象,其中男68例,女40例; 年龄35~75岁,平均(60.36±9.54)岁; 体质量指数19~30 kg/m2, 平均(20.17±3.15) kg/m2。按照治疗结果将患者分为生存组(n=86) 和死亡组(n=22)。生存组年龄(60.16±9.54)岁,男56例,女30例,体质量指数(20.14±4.23) kg/m2, 吸烟史4例,饮酒史11例; 死亡组(60.67±9.46)岁,男12例,女10例,体质量指数(20.30±4.25) kg/m2, 吸烟史3例,饮酒史4例。2组年龄、性别、体质量指数、吸烟史、饮酒史等基本资料比较,差异无统计学意义(P>0.05)。纳入标准: ①符合重症肺结核的诊断标准[8],形成3个肺野以上的肺部结核病灶,有空洞或长时间排菌,有明显结核病毒性症状以及红细胞沉降率增加者; ②无其他疾病呼吸系统者; ③患者均已成年且临床数据完整者; ④患者配合度高; ⑤患者及监护人签署同意书; ⑥由同一医师小组治疗,且治疗方案相同者。本研究经医院伦理委员会审核通过。排除标准: ①有其他恶性肿瘤者; ②严重器官功能障碍者; ③有酗酒史、吸毒史者; ④有其他传染性疾病者。
1.2 方法
1.2.1 血清Sestrin2、Fetuin-A水平检测
入院24 h内采集患者空腹状态下静脉血,经离心处理后,保留上层清液,采用酶联免疫吸附法检测Sestrin2、Fetuin-A水平(试剂盒由云克隆科技股份有限公司生产)。
1.2.2 急性生理学及慢性健康状况评分系统(APACHEⅡ)评分[9]
入院24 h内采用APACHE Ⅱ评分对患者病情严重程度予以评估,包括年龄(0~6分)、急性生理(0~48分)及慢性健康评分(0~10分),分数与疾病严重程度呈正相关。
1.3 疾病转归
根据治疗30 d内存活情况将患者分为生存组和死亡组,判定死亡的标准: 心跳停止; 无自主呼吸,呼吸停止; 脑组织和脑细胞死亡,脑功能完全丧失,均可判为死亡。
1.4 统计学分析
采用软件SPSS 23.0对数据进行处理,符合正态分布的计量资料以(x±s)表示,组间比较行t检验; 计数资料采用[n(%)]表示,组间比较行χ2检验; 采用Logistic回归分析观察重症肺结核患者预后的影响因素; 采用受试者工作特征(ROC)曲线及曲线下面积(AUC)分析血清Sestrin2、Fetuin-A与重症肺结核患者疾病转归的关系。P<0.05为差异有统计学意义。
2. 结果
2.1 2组血清Sestrin2、Fetuin-A水平比较
死亡组血清Sestrin2水平高于生存组,生存组血清Fetuin-A水平高于死亡组,差异有统计学意义(P<0.05), 见表 1。
表 1 2组血清应激诱导蛋白2和胎球蛋白A水平比较(x±s)组别 n 应激诱导蛋白2/(ng/mL) 胎球蛋白A/(μg/mL) 生存组 86 10.67±2.95 392.36±38.82 死亡组 22 15.29±3.34* 332.15±36.79* 与生存组比较, * P<0.05。 2.2 血清Sestrin2、Fetuin-A对重症肺结核疾病转归的预测价值
血清Sestrin2、Fetuin-A预测重症肺结核患者疾病转归的AUC分别为0.752、0.887, 两者联合预测的AUC为0.920, 见表 2、图 1。
表 2 血清应激诱导蛋白2和胎球蛋白A水平对重症肺结核患者疾病转归的预测价值检测指标 AUC 95%CI 截断值 特异度/% 灵敏度/% 应激诱导蛋白2 0.752 0.712~0.797 12.39 ng/mL 55.64 92.73 胎球蛋白A 0.887 0.842~0.937 350.67 μg/mL 65.57 92.73 联合预测 0.920 0.875~0.970 — 86.06 88.21 2.3 重症肺结核患者疾病转归的单因素分析
死亡组糖尿病史占比高于生存组,呼气流量峰值(PEF)、最大呼气中段流量(MMEF)、第1秒用力呼气容积(FEV1)水平、左心室射血分数(LVEF)低于生存组,差异有统计学意义(P<0.05), 见表 3。
表 3 重症肺结核患者疾病转归的单因素分析指标 生存组(n=86) 死亡组(n=22) 糖尿病 13(15.12) 8(36.36)* 左心室射血分数/% 56.87±6.54 48.26±5.59* 呼气流量峰值/L 6.94±0.84 4.27±0.79* 最大呼气中段流量/% 2.95±0.39 1.58±0.25* 第1秒用力呼气容积/L 4.10±0.56 2.21±0.38* 与生存组比较, * P<0.05。 2.4 重症肺结核患者疾病转归的多因素Logistic回归分析
本研究将重症肺结核患者的疾病转归作为因变量(生存=0、死亡=1), 将单因素分析有意义的指标及Sestrin2、Fetuin-A血清水平作为自变量进行多因素Logistic回归分析,结果显示,血清Sestrin2(OR=5.709, 95%CI: 1.993~16.355)、血清Fetuin-A(OR=4.826, 95%CI: 1.797~12.960)是重症肺结核疾病转归的危险因素(P<0.05), 见表 4。
表 4 重症肺结核患者有关疾病转归的多因素Logistic回归分析变量 回归系数 标准误 Wald χ2 P OR(95%CI) 左心室射血分数 1.329 0.509 6.817 <0.001 3.777(1.393~10.243) 应激诱导蛋白2 1.742 0.537 10.523 <0.001 5.709(1.993~16.355) 胎球蛋白A 1.574 0.504 9.753 <0.001 4.826(1.797~12.960) 赋值: 左心室射血分数(≤50.00%=0, >50.00%=1); 应激诱导蛋白2(<12.39 ng/mL=0, ≥12.39 ng/mL=1);
胎球蛋白A(<350.67 μg/mL=1, ≥350.67 μg/mL=0)。3. 讨论
肺结核救治难度较大,有极高的病死率[10]。研究[11]报道,中国是结核病高负担国家之一,新发结核病病例超80万例,发病率为58/100 000, 肺结核防控与治疗工作仍面临挑战。如果患者不能得到及时处理,病变可能会导致病情延长及恶化,从而加重患者病情。当病情发展成重症肺结核时,患者器官组织会迅速出现功能衰竭,甚至危及生命。因此,早期判断患者与此疾病转归相关的特异性指标,对于早期诊断及预后评估非常重要。
Sestrin2为缺氧诱导基因95, 具有抗氧化功能,是人体各个系统种抗氧化防御机制的重要组成部分[12]。Sestrin2可与细胞内很多信号通路产生互相作用,并利用调控如凋亡、自噬、线粒体稳态、内质网应激等细胞生物学相关功能,保护细胞不会被氧化应激所影响,在多种呼吸代谢疾病中发挥重要作用[13-14]。既往研究[15]发现,哮喘与氧化应激密切相关, Sestrin2在哮喘急性发作中和急性发作后都有明显上升,并与FEV1呈正相关。在阻塞性睡眠呼吸暂停综合征患者尿液中亦检测出Sestrin2蛋白,且浓度水平较对照组高,以上研究均证实Sestrin2可作为呼吸系统方面疾病重要检测标志物,有助于治疗呼吸系统相关疾病。
本研究结果显示,死亡组血清Sestrin2水平高于生存组,提示血清Sestrin2水平在重症肺结核患者中表达上调,可作为患者疾病转归的指标,原因为重症肺结核造成的患者免疫低下,释放大量炎性因子, Sestrin2的表达上升显著,能够利用其内在的还原酶活性加速过氧化物氧化还原酶的再循环从而使氧化应激减轻,亦能够被Nrf2、P53、转录激活因子-1和FoxO等各种转录因子转录诱导,达到人体免受氧化应激影响的效果[16-18], 进而限制了器官发生进行性损伤。结果显示,血清Sestrin2预测重症肺结核患者疾病转归的AUC为0.752, 灵敏度为92.73%; 血清Sestrin2 ≥12.39 ng/mL是重症肺结核患者疾病转归的影响因素,提示检测血清Sestrin2水平可作为预测重症肺结核患者疾病转归事件的指标。Fetuin-A属于半胱氨酸蛋白酶抑制物超基因家族中一种多功能蛋白,与心血管疾病、自身免疫性疾病、肿瘤、感染等相关[19]。本研究结果显示,生存组血清Fetuin-A水平高于死亡组,且死亡组血清Fetuin-A水平低于生存组,提示血清Fetuin-A在重症肺结核患者中呈下降趋势,并影响患者疾病转归。人血清Fetuin-A是一种主要由肝脏分泌的糖蛋白,拥有丰富的生物功能,可以充当一种负向调节蛋白,对机体炎症反应起着抑制作用。
本研究结果显示,血清Fetuin-A浓度在重症肺结核疾病中表达下降,且死亡组Fetuin-A水平低于生存组,本研究与上述相关研究结果一致,提示Fetuin-A可能成为预测重症肺结核疾病转归的指标。结果显示,血清Fetuin-A预测重症肺结核患者化疗相关心脏毒性的AUC为0.887, 灵敏度为92.73%; 血清Fetuin-A<350.67 mg/L是重症肺结核疾病转归的影响因素,表明Fetuin-A可作为预测重症肺结核疾病转归的辅助指标,且Fetuin-A低表达会使病死率增高。
综上所述,血清Sestrin2、Fetuin-A水平变化与重症肺结核的疾病转归密切相关,可作为评估重症肺结核的生物学指标,且两者联合预测的效能更高。本研究也存在一定不足: 研究范围和样本量小,未长期对患者疾病转归效果进行充分评估,无法全面了解患者的预后情况,因此还需要扩大样本量,延长观察时间以进一步确认研究效果。
-
表 1 2组面部头影测量指标结果比较(x±s)
mm 组别 n N-Me N-ANS ANS-Me S-Go 健康对照组 78 105.28±5.49 45.65±3.64 63.85±7.94 65.01±6.47 OSAS组 78 110.67±6.71 46.77±4.65 67.92±7.14 65.44±6.13 t 5.491 1.675 3.366 0.426 P <0.001 0.096 0.001 0.671 N-Me: 面部前高度; N-ANS: 面部上前高度; ANS-Me: 面部前下高度; S-Go: 面部后部总高度。 表 2 2组患儿舌骨位置测量结果比较(x±s)
mm 组别 n HyS C3-H HyMP Dh-H Dv-H 健康对照组 78 86.52±6.37 30.11±4.22 8.01±2.46 25.47±4.04 42.46±6.17 OSAS组 78 98.48±7.69 35.86±6.39 15.71±2.83 28.98±4.57 54.99±9.72 t 10.578 6.632 18.136 5.082 9.612 P <0.001 <0.001 <0.001 <0.001 <0.001 HyS: 舌骨点至下颌平面的垂直距离; C3-H: 舌骨体之最前上方至第三颈椎之最前下点的线性距离;
HyMP: 舌骨最前点至腭平面的垂直距离; Dh-H: 舌骨最前点; Dv-H: 舌骨最后点。 -
[1] 陈一冰, 赵明, 李丹, 等. 体重指数对高龄阻塞性睡眠呼吸暂停综合征患者的影响及其临床特征[J]. 中国临床保健杂志, 2021, 24(6): 831-834. [2] TANELLARI O, TOTI C, BARUTI PAPA E, et al. The link between obstructive sleep apnea syndrome and cephalometric assessment of upper airways and hyoid bone position[J]. Medicina, 2022, 58(9): 1213. doi: 10.3390/medicina58091213
[3] MAHALE A R, RAO P, ULLAL S, et al. Computed tomography and cephalometric evaluation of obstructive sleep apnea syndrome[J]. Indian J Otolaryngol Head Neck Surg, 2022, 74(3): 5134-5143.
[4] POLLIS M, LOBBEZOO F, AARAB G, et al. Correlation between apnea severity and sagittal cephalometric features in a population of patients with polysomnographically diagnosed obstructive sleep apnea[J]. J Clin Med, 2022, 11(15): 4572. doi: 10.3390/jcm11154572
[5] DIAS FERRAZ P, FRANCISCO I, BORGES M I, et al. Pharyngeal airspace alterations after using the mandibular advancement device in the treatment of obstructive sleep apnea syndrome[J]. Life, 2022, 12(6): 835. doi: 10.3390/life12060835
[6] EMSAEILI F, SADRHAGHIGHI A, SADEGHI-SHABESTARI M, et al. Comparison of superior airway dimensions and cephalometric anatomic landmarks between 8-12-year-old children with obstructive sleep apnea and healthy children using CBCT images[J]. J Dent Res Dent Clin Dent Prospects, 2022, 16(1): 18-23. doi: 10.34172/joddd.2022.003
[7] 竺飞燕, 王云玲, 金鑫, 等. 老年中重度阻塞性睡眠呼吸暂停综合征患者的睡眠结构特征与认知障碍的关系研究[J]. 浙江医学, 2021, 43(22): 2422-2425. [8] BOKOV P, DAHAN J, BOUJEMLA I, et al. Prevalence of mouth breathing, with or without nasal obstruction, in children with moderate to severe obstructive sleep apnea[J]. Sleep Med, 2022, 98: 98-105. doi: 10.1016/j.sleep.2022.06.021
[9] JEONG H G, KIM T, HONG J E, et al. Automated deep neural network analysis of lateral cephalogram data can aid in detecting obstructive sleep apnea[J]. J Clin Sleep Med, 2023, 19(2): 327-337. doi: 10.5664/jcsm.10258
[10] KIM Y J, SHIN H K, LEE D Y, et al. Decreased maxillary sinus volume is a potential predictor of obstructive sleep apnea[J]. Angle Orthod, 2020, 90(4): 556-563. doi: 10.2319/080819-520.1
[11] JO J H, PARK J W, JANG J H, et al. Polysomnographic and cephalometric evaluation of patients with obstructive sleep apnea according to obesity level[J]. J Oral Med Pain, 2022, 47(3): 135-143. doi: 10.14476/jomp.2022.47.3.135
[12] ALIMOGLU Y, ALTIN F, YORGUNER N E, et al. Predicting the outcome after adenoidectomy-alone for adenoid hypertrophy causing sleep disordered breathing[J]. Am J Otolaryngol, 2020, 41(6): 102646. doi: 10.1016/j.amjoto.2020.102646
[13] MARCZAK A, WALERZAK M, TOKARSKA P, et al. Role of cephalometry and cone beam computed tomography in the diagnostics of obstructive sleep apnea[J]. For, 2022, 18(3): 167-177. doi: 10.5114/for.2022.122045
[14] 许梅杰, 钱文霞, 许梅花, 等. 脂蛋白相关磷脂酶A2水平与阻塞性睡眠呼吸暂停综合征患者并发心血管疾病的关系[J]. 实用临床医药杂志, 2023, 27(3): 6-10. doi: 10.7619/jcmp.20223291 [15] ABDEL-AZIZ M, EL-FOULY M, ELMAGD E A A, et al. Adenoid hypertrophy causing obstructive sleep apnea in children after pharyngeal flap surgery[J]. Eur Arch Oto Rhino Laryngol, 2019, 276(12): 3413-3417. doi: 10.1007/s00405-019-05633-z
[16] 崔菲菲, 陈超, 刘静, 等. 中枢性呼吸暂停在儿童阻塞性睡眠呼吸暂停综合征中分布特征研究[J]. 中国实用儿科杂志, 2021, 36(6): 459-462. [17] CARUSO S, LISCIOTTO E, CARUSO S, et al. Effects of rapid maxillary expander and delaire mask treatment on airway sagittal dimensions in pediatric patients affected by class Ⅲ malocclusion and obstructive sleep apnea syndrome[J]. Life, 2023, 13(3): 673. doi: 10.3390/life13030673
[18] GALEOTTI A, GATTO R, CARUSO S, et al. Effects of rapid palatal expansion on the upper airway space in children with obstructive sleep apnea (OSA): a case-control study[J]. Children, 2023, 10(2): 244. doi: 10.3390/children10020244
[19] 周驰, 王旭, 姜虹, 等. 头影测量用于阻塞性睡眠呼吸暂停低通气综合征患者困难插管预测的效果评价[J]. 上海口腔医学, 2019, 28(3): 317-320. [20] 梁燕珍, 曹姝平, 邹姣云. 不同年龄阶段阻塞性睡眠呼吸暂停综合征患儿临床特征差异[J]. 中国现代药物应用, 2018, 12(13): 43-44. [21] 赵娜, 鲁海平. 低温等离子手术治疗儿童阻塞性睡眠呼吸暂停低通气综合征疗效分析[J]. 中国临床医生杂志, 2021, 49(1): 111-114. [22] 张子奇, 王舒泽, 张斌, 等. 上气道形态评估与阻塞性睡眠呼吸暂停关系的研究进展[J]. 实用临床医药杂志, 2022, 26(6): 139-144. doi: 10.7619/jcmp.20214708 [23] MITTAL R, LEE L A, LIN C H, et al. Prediction of tongue obstruction observed from drug induced sleep computed tomography by cephalometric parameters[J]. Auris Nasus Larynx, 2019, 46(3): 384-389. doi: 10.1016/j.anl.2018.08.016
[24] BHARGAVA A, SALUJA I, BHARGAVA A, et al. Application of Berlin questionnaire in obstructive sleep apnea syndrome through soft palate morphology types[J]. J Edu Health Promot, 2022, 11(1): 377.




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号