A case report of elderly patient with refractory severe aplastic anemia by treatment of avatrombopag in combination with tacrolimus
-
摘要:目的
总结阿伐曲泊帕联合他克莫司治疗老年难治性重型再生障碍性贫血的临床疗效和不良反应。
方法报道1例阿伐曲泊帕联合他克莫司治疗老年难治性重型再生障碍性贫血患者,并针对阿伐曲泊帕、他克莫司作用机制及安全性进行文献复习。
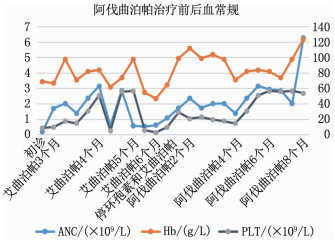
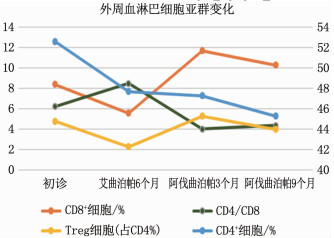
结果患者经环孢素、十一酸睾酮、艾曲泊帕联合治疗6个月无效,并出现肝肾功能损伤,停药并予以阿伐曲泊帕(20 mg, 每日1次)联合他克莫司(1 mg, 每日2次)治疗9个月后,患者血小板升至54×109/L, 血红蛋白升至124 g/L, 白细胞升至8.23×109/L, 肝肾功能也均恢复到正常, 未观察到血栓事件等其他不良反应,且治疗后CD4/CD8下降, CD8+T细胞增多, Treg细胞比例增多。
结论阿伐曲泊帕联合他克莫司治疗老年难治性再生障碍性贫血有效且耐受性良好,今后仍需长期追踪观察及继续积累病例。
-
关键词:
- 难治性再生障碍性贫血 /
- 老年患者 /
- 阿伐曲泊帕 /
- 他克莫司 /
- 艾曲泊帕
Abstract:ObjectiveTo summarize the clinical effect and adverse reactions of avatrombopag combined with tacrolimus in the treatment of elderly patient with refractory severe aplastic anemia.
MethodsAn elderly patient with refractory severe aplastic anemia was treated with avatrombopag and tacrolimus, and the literature review on the mechanism of action and safety of avatrombopag and tacrolimus was conducted.
ResultsThe patient was treated with a combination of cyclosporine, testosterone undecanoate, and itraconazole for 6 months without success, and developed liver and kidney dysfunction. The medication was discontinued, and the patient was treated with a combination of avatrombopag (20 mg, once per day) and tacrolimus (1 mg, twice per day). After 9 months of treatment, the patient's platelet count increased to 54×109/L, the hemoglobin increased to 124 g/L, the white blood cells increased to 8.23×109/L, liver and kidney function also returned to normal level, and no other adverse reactions such as thrombotic events were observed. After treatment, CD4/CD8 decreased, CD8+ T cells increased, and the proportion of Treg cells increased as well.
ConclusionThe combination of avatrombopag and tacrolimus is effective and well tolerated in the treatment of elderly patient with refractory aplastic anemia, but the long-term follow-up observation and continued accumulation of cases are still needed in the future.
-
Keywords:
- refractory aplastic anemia /
- elderly patients /
- avatrombopag /
- tacrolimus /
- eltrombopag
-
复发性流产是妇产科常见疾病,包括生化妊娠,其在育龄女性中的发病率约为5%, 且呈逐渐升高趋势[1-3]。随着自然流产次数的增多,复发性流产的发生风险也会随之升高。引发复发性流产的原因较多,常见原因包括子宫发育不良、感染、精神紧张等。60%~70%患者的发病原因不明[4-5]。复发性流产会导致妊娠结局变差,影响患者的心理健康。抗凝治疗是该病的首选疗法。阿司匹林为常用抗凝药,可有效抑制血栓形成,且能改善炎性浸润,但单用阿司匹林效果欠佳[6-7]。低分子肝素钙对改善血栓前状态有较好的临床疗效[8]。本研究探讨低分子肝素钙联合小剂量阿司匹林在复发性流产患者中的应用效果,现报告如下。
1. 资料与方法
1.1 一般资料
选取2021年1月—2023年9月本院妇产科收治的180例复发性流产患者为研究对象,按照随机数表法分成对照组与观察组,每组90例。对照组年龄20~44岁,平均(30.88±4.47)岁; 体质量52~75 kg, 平均(58.26±4.58) kg; 流产次数2~5次,平均(3.46±0.90)次。观察组年龄20~45岁,平均(30.92±4.43)岁; 体质量52~75 kg, 平均(58.30±4.55) kg; 流产次数2~5次,平均(3.51±0.87)次。2组上述资料比较,差异无统计学意义(P>0.05)。本研究已获得医院伦理委员会审批(2021-TZFY-008-01)。
纳入标准: ①年龄20~45岁者; ②经临床检查证实,满足《复发性流产抗血栓药物治疗中国专家共识》[9]中复发性流产的诊断规定者; ③夫妻双方染色体核型正常; ④患者或家属对研究知晓,自愿加入。排除标准: ①血常规、凝血功能障碍者; ②生殖道感染或畸形者; ③主要脏器疾病者; ④对本研究药物具有禁忌证者; ⑤感染性疾病者; ⑥癌症者; ⑦瘢痕子宫者; ⑧带器宫内妊娠者; ⑨精神病、意识障碍者。
1.2 方法
2组均于备孕前3个月至妊娠12周服用叶酸片(江西制药,国药准字H36020872), 0.4 g/次, 1次/d; 确认为宫内妊娠后,肌注绒毛膜促性素(Merck Serono S. p. A., 注册证号S20110045) 1 000 U/次, 1次/d, 用药1~2周; 肌注黄体酮注射液(昆药集团,国药准字H53020916), 20 mg/次, 1次/d, 用药至妊娠10周后改为口服黄体酮胶囊(浙江仙琚,国药准字H20041902), 100 mg/次,2次/d, 用药至妊娠12周。口服维生素E片(上海新黄河,国药准字H31021028), 100 mg/次, 3次/d, 用药至妊娠20周。对照组给予小剂量阿司匹林治疗: 口服阿司匹林片(哈药集团,国药准字H23021185), 0.75 g/次, 1次/d, 用药至妊娠20周。观察组给予低分子肝素钙联合小剂量阿司匹林治疗: 经脐周皮下注射低分子肝素钙注射液(深圳赛保尔,国药准字H20060190), 3 000 IU/次(0.6 mL), 1次/d, 用药至妊娠20周; 小剂量阿司匹林用药方法同对照组。2组用药期间,每周检测1次凝血功能、血小板计数等,出现异常则酌情减少药量或停药,保胎失败则终止妊娠。2组均随访至终止妊娠。
1.3 观察指标
血栓前状态: 纤溶酶原激活抑制剂-1(PAI-1)、组织型纤溶酶原激活物(t-PA)、抗凝血酶Ⅲ(AT-Ⅲ)、蛋白S(PS), 于治疗前、妊娠20周晨起空腹采血,分别应用酶联免疫吸附法、显色底物法、凝固法进行检测。
凝血功能: 凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、血小板计数(PLT), 于治疗前、妊娠20周晨起空腹采血,应用全自动血凝分析仪进行检测。
激素水平: 绒毛膜促性腺激素(HCG)、雌二醇(E2)、孕酮(P),于治疗前、妊娠20周晨起空腹采血,应用生化分析仪进行检测。
妊娠结局: 流产、早产死胎、早产活婴、足月分娩,早产活婴、足月分娩视为保胎成功,计算保胎成功率。
不良反应: 观察2组不良反应发生情况,计算不良反应总发生率。
1.4 统计学分析
采用SPSS 22.0软件进行数据分析,符合正态分布的计量资料以(x±s)表示,行t检验,计数资料以[n(%)]表示,行χ2检验。P<0.05为差异有统计学意义。
2. 结果
2.1 血栓前状态比较
治疗后, 2组PAI-1、t-PA降低, AT-Ⅲ、PS升高,且观察组PAI-1、t-PA低于对照组, AT-Ⅲ、PS均高于对照组,差异有统计学意义(P<0.05)。见表 1。
表 1 血栓前状态比较(x±s)指标 时点 对照组(n=90) 观察组(n=90) PAI-1/(μg/L) 治疗前 42.46±7.65 42.49±7.63 妊娠20周 26.15±5.37* 20.83±4.22*# t-PA/(μg/L) 治疗前 13.16±1.97 13.20±1.94 妊娠20周 11.06±1.12* 10.48±0.92*# AT-Ⅲ/% 治疗前 82.20±7.51 82.25±7.48 妊娠20周 98.01±8.35* 107.78±9.21*# PS/% 治疗前 83.94±10.34 83.99±10.31 妊娠20周 90.92±11.21* 98.64±12.04*# PAI-1: 纤溶酶原激活抑制剂-1;
t-PA: 组织型纤溶酶原激活物; AT-Ⅲ: 抗凝血酶Ⅲ; PS: 蛋白S。
与治疗前比较, *P<0.05; 与对照组比较, #P<0.05。2.2 凝血功能比较
治疗后, 2组PT、TT、APTT升高, FIB、PLT降低,且观察组PT、TT、APTT高于对照组, FIB、PLT低于对照组,差异有统计学意义(P<0.05)。见表 2。
表 2 凝血功能比较(x±s)指标 时点 对照组(n=90) 观察组(n=90) PT/s 治疗前 10.73±1.67 10.77±1.63 妊娠20周 11.48±1.75* 12.57±1.81*# TT/s 治疗前 14.27±1.23 14.30±1.25 妊娠20周 15.62±1.50* 16.48±1.56*# APTT/s 治疗前 25.34±4.15 25.31±4.18 妊娠20周 26.72±4.52* 28.45±4.77*# FIB/(g/L) 治疗前 4.55±0.52 4.57±0.50 妊娠20周 3.98±0.44* 3.52±0.40*# PLT/(×109/L) 治疗前 204.23±24.57 204.30±24.51 妊娠20周 179.34±18.93* 160.40±18.23*# PT: 凝血酶原时间; TT: 凝血酶时间;
APTT: 活化部分凝血活酶时间;
FIB: 纤维蛋白原; PLT: 血小板计数。
与治疗前比较, *P<0.05; 与对照组比较, #P<0.05。2.3 激素水平比较
治疗后, 2组HCG、E2、P升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表 3。
表 3 激素水平比较(x±s)组别 HCG/(IU/L) E2/(ng/L) P/(μg/L) 治疗前 妊娠20周 治疗前 妊娠20周 治疗前 妊娠20周 对照组(n=90) 992.43±101.74 6 452.87±734.23* 365.83±39.75 414.76±33.40* 8.94±2.17 22.63±2.49* 观察组(n=90) 990.84±105.82 6 873.28±790.40*# 364.59±40.17 460.68±38.37*# 8.76±2.21 28.55±3.04*# HCG: 绒毛膜促性腺激素; E2: 雌二醇; P: 孕酮。与治疗前比较, *P<0.05; 与对照组比较, #P<0.05。 2.4 妊娠结局比较
观察组保胎成功率高于对照组,差异有统计学意义(P<0.05)。见表 4。
表 4 妊娠结局比较[n(%)]组别 流产 早产死胎 早产活婴 足月分娩 保胎成功 对照组(n=90) 18(20.00) 7(7.78) 10(11.11) 55(61.11) 65(72.22) 观察组(n=90) 9(10.00) 2(2.22) 15(16.67) 64(71.11) 79(87.78)* 与对照组比较, *P<0.05。 2.5 不良反应比较
2组不良反应总发生率比较,差异无统计学意义(P>0.05)。见表 5。
表 5 不良反应比较[n(%)]组别 皮下瘀斑 牙龈出血 胃肠道反应 血小板减少 合计 对照组(n=90) 2(2.22) 1(1.11) 2(2.22) 1(1.11) 6(6.67) 观察组(n=90) 2(2.22) 1(1.11) 1(1.11) 0 4(4.44) 3. 讨论
复发性流产是自然流产的形式之一,多数患者胚胎着床后初期终止发育,导致流产[10]。随着工作与生活压力的增加,女性复发性流产的发生率呈逐渐升高的发展趋势。复发性流产可导致妊娠失败、长期不育或永久性不育,还会影响夫妻关系、婆媳关系及家庭和睦。因此,对该病进行早期诊断、治疗非常重要。复发性流产的发病机制非常复杂,可能与多种因素有关,其中血栓形成和凝血功能异常在复发性流产的发病中起重要作用。
阿司匹林可降低血小板环氧酶活性,预防血栓形成[11-13], 纠正异常子宫血流灌注,改善胎盘血液循环[14]。动物实验研究[15-16]发现,阿司匹林过量使用有致畸风险,但阿司匹林750~1 500 mg/d给药为安全、有效的。故本研究采用小剂量阿司匹林(0.75 g/d)用药。低分子肝素钙是一种抗凝血药物,通过抑制凝血酶的活性,阻止血栓形成。其具有较高的生物利用度和较长的半衰期,因此可以通过皮下注射给药,方便患者使用。低分子肝素钙还可增加AT-Ⅲ的活性,从而进一步增强抗凝血能力,且出血风险小,不易和血小板结合,可有效预防血小板减少[17]。低分子肝素能够达到较好的保胎效果[18-19]。探讨阿司匹林与低分子肝素联合用药的效果具有重要意义[20-21]。
血栓前状态通过影响胎盘血供,导致胎儿缺血、缺氧,甚至停育,最终影响妊娠结局。低分子肝素钙和小剂量阿司匹林的联用可以产生协同效应,从而更好地改善复发性流产患者的血栓前状态和凝血功能。本研究显示,观察组治疗后的PAI-1、t-PA均显著低于对照组,且AT-Ⅲ、PS均显著高于对照组,提示观察组患者的血栓前状态得到了更好的调节,血栓形成的风险较低,分析原因与低分子肝素钙具有抑制血栓形成作用有直接关系。妊娠后,凝血时间会缩短,且呈高凝状态,以防产后出血,但若高凝状态异常且持续时间过长,则易引发血栓,导致胚胎缺氧、缺血,因此改善患者的凝血功能非常有必要。本研究中,观察组治疗后的PT、TT、APTT显著较高,且FIB、PLT显著较低,提示观察组患者的凝血功能改善效果更好,说明联合治疗能够更有效调节患者的凝血功能。
此外,低分子肝素钙联合小剂量阿司匹林还可以调节激素水平。在妊娠过程中,激素平衡对于维持妊娠的稳定性非常重要。HCG是诊断早期妊娠的主要参考依据。在妊娠初期, HCG的水平会迅速上升,并在妊娠8~11周达到峰值,然后逐渐下降。E2和P是由卵巢产生的激素,在妊娠过程中起着重要调节作用。随着妊娠黄体和胎盘的形成, E2和P的表达水平逐渐升高。E2主要由卵泡细胞产生,在妊娠早期起着促进子宫内膜增厚和胚胎着床的作用。P主要由黄体和胎盘产生,在妊娠早期起着维持妊娠的作用,有助于子宫内膜的稳定和胚胎的发育。复发性流产患者由于滋养层萎缩,其激素水平会显著低于正常妊娠孕妇。本研究显示,观察组治疗后的HCG、E2、P显著更高,提示观察组患者的激素水平较高,说明联合治疗可以更好调节患者的激素水平,提高妊娠成功率。观察组保胎成功率显著高于对照组,进一步证实联合治疗的应用优势及安全性。这可能与低分子肝素钙联合小剂量阿司匹林可改善患者的凝血功能、调节激素水平以及预防血栓形成有关。在治疗复发性流产时,低分子肝素钙联合小剂量阿司匹林的优势不仅在于其治疗效果,还在于其安全性。本研究结果显示,观察组和对照组的不良反应发生率相近,说明低分子肝素钙联合小剂量阿司匹林治疗的安全性较好。但不同患者对药物的反应可能存在差异,因此需密切监测患者的情况,并根据其具体情况进行调整。
综上所述,低分子肝素钙联合小剂量阿司匹林治疗复发性流产患者具有显著的临床效果,可有效改善患者的血栓前状态、凝血功能和激素水平,提高妊娠结局和保胎成功率,且具有较好的安全性。但本研究存在一定的不足,本研究病例数较少,结果可能存在偏倚,因此仍需扩大样本量以进一步验证。
-
[1] 付蓉, 王婷. 再生障碍性贫血诊断与治疗中国指南(2022年版)解读[J]. 中华血液学杂志, 2023, 44(3): 188-192. [2] KILLICK S B, BOWN N, CAVENAGH J, et al. Guidelines for the diagnosis and management of adult aplastic anaemia[J]. Br J Haematol, 2016, 172(2): 187-207. doi: 10.1111/bjh.13853
[3] IFTIKHAR R, CHAUDHRY Q U N, ANWER F, et al. Allogeneic hematopoietic stem cell transplantation in aplastic anemia: current indications and transplant strategies[J]. Blood Rev, 2021, 47: 100772. doi: 10.1016/j.blre.2020.100772
[4] 任悦, 李杨, 刘春燕, 等. 他克莫司在治疗重型再生障碍性贫血中的免疫调节作用[J]. 中华医学杂志, 2021, 101(24): 1929-1934. doi: 10.3760/cma.j.cn112137-20201228-03484 [5] SCHEINBERG P. Activity of eltrombopag in severe aplastic anemia[J]. Hematology Am Soc Hematol Educ Program, 2018, 2018(1): 450-456. doi: 10.1182/asheducation-2018.1.450
[6] NOMOTO H, MORIMOTO N, MIURA K, et al. Lusutrombopag is effective and safe in patients with chronic liver disease and severe thrombocytopenia: a multicenter retrospective study[J]. BMC Gastroenterol, 2020, 20(1): 427. doi: 10.1186/s12876-020-01573-9
[7] KULASEKARARAJ A G, MARSH J C W. Romiplostim in aplastic anaemia-another tool in the armamentarium[J]. Br J Haematol, 2021, 192(1): 15-16. doi: 10.1111/bjh.17189
[8] SHIRLEY M. Avatrombopag: first global approval[J]. Drugs, 2018, 78(11): 1163-1168. doi: 10.1007/s40265-018-0949-8
[9] QUINTINO DE OLIVEIRA B, CATTO L F B, SANTANA B A A, et al. Eltrombopag preferentially expands haematopoietic multipotent progenitors in human aplastic anaemia[J]. Br J Haematol, 2021, 193(2): 410-414. doi: 10.1111/bjh.17140
[10] DESMOND R, TOWNSLEY D M, DUMITRIU B, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug[J]. Blood, 2014, 123(12): 1818-1825. doi: 10.1182/blood-2013-10-534743
[11] OLNES M J, SCHEINBERG P, CALVO K R, et al. Eltrombopag and improved hematopoiesis in refractory aplastic Anemia[J]. N Engl J Med, 2012, 367(1): 11-19. doi: 10.1056/NEJMoa1200931
[12] TOWNSLEY D M, SCHEINBERG P, WINKLER T, et al. Eltrombopag added to standard immunosuppression for aplastic Anemia[J]. N Engl J Med, 2017, 376(16): 1540-1550. doi: 10.1056/NEJMoa1613878
[13] GONZALEZ-PORRAS J R, BASTIDA J M. Eltrombopag in immune thrombocytopenia: efficacy review and update on drug safety[J]. Ther Adv Drug Saf, 2018, 9(6): 263-285. doi: 10.1177/2042098618769587
[14] LEE J T, WHITSON B A, KELLY R F, et al. Calcineurin inhibitors and Clostridium difficile infection in adult lung transplant recipients: the effect of cyclosporine versus tacrolimus[J]. J Surg Res, 2013, 184(1): 599-604. doi: 10.1016/j.jss.2013.03.041
[15] DU Y L, HUANG Y Z, ZHOU W Z, et al. Effective tacrolimus treatment for patients with non-severe aplastic Anemia that is refractory/intolerant to cyclosporine A: a retrospective study[J]. Drug Des Devel Ther, 2020, 14: 5711-5719. doi: 10.2147/DDDT.S275975
[16] ABDELA J. Current advance in thrombopoietin receptor agonists in the management of thrombocytopenia associated with chronic liver disease: focus on avatrombopag[J]. Clin Med Insights Blood Disord, 2019, 12: 1179545X19875105.
[17] FUKUSHIMA-SHINTANI M, SUZUKI K I, IWATSUKI Y, et al. AKR-501(YM477) a novel orally-active thrombopoietin receptor agonist[J]. Eur J Haematol, 2009, 82(4): 247-254. doi: 10.1111/j.1600-0609.2008.01198.x
[18] BUSSEL J B, KUTER D J, ALEDORT L M, et al. A randomized trial of avatrombopag, an investigational thrombopoietin-receptor agonist, in persistent and chronic immune thrombocytopenia[J]. Blood, 2014, 123(25): 3887-3894. doi: 10.1182/blood-2013-07-514398
[19] JURCZAK W, CHOJNOWSKI K, MAYER J, et al. Phase 3 randomised study of avatrombopag, a novel thrombopoietin receptor agonist for the treatment of chronic immune thrombocytopenia[J]. Br J Haematol, 2018, 183(3): 479-490.
[20] 刘晓庆, 杨慧, 李瑞鑫, 等. 阿伐曲泊帕治疗肝肾功能异常的严重型再生障碍性贫血8例分析[J]. 中国实用内科杂志, 2021, 41(10): 863-866, 889. https://www.cnki.com.cn/Article/CJFDTOTAL-SYNK202110011.htm [21] 杨洁茹, 王化泉, 邵宗鸿. 艾曲泊帕治疗再生障碍性贫血作用机制的研究进展[J]. 中华医学杂志, 2020, 100(32): 2557-2560. [22] DING S X, LIANG X W, ZHANG T, et al. The effectiveness of rapamycin combined with eltrombopag in murine models of immune-mediated bone marrow failure[J]. J Immunol Res, 2020, 2020: 1798795.
-
期刊类型引用(3)
1. 蒋春芳,吴晓萍,沈云士. 门诊处方前置审核系统对生殖中心用药合理化分析. 医药前沿. 2025(03): 129-133 .  百度学术
百度学术
2. 郭秀荣. 低分子肝素钠联合阿司匹林治疗复发性流产的安全性评价. 中外医疗. 2024(33): 27-30 .  百度学术
百度学术
3. 刘娟,马汝婵. 烯丙雌醇联合低分子肝素钠治疗对复发性流产患者子宫血流灌注和凝血功能的影响. 智慧健康. 2024(35): 63-66 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
