Risk factors identification for prognosis of ovarian cancer patients with lung metastasis and establishment of nomogram
-
摘要:目的
基于美国监测、流行病学和最终结果数据库(SEER)探讨卵巢癌肺转移患者预后的独立影响因素并建立生存率预测模型。
方法收集2010—2015年1 804例卵巢癌肺转移患者的临床数据,按2∶1比例分为建模集(1 203例)和验证集(601例),通过Cox回归分析评估卵巢癌肺转移患者预后的独立影响因素并建立生存率列线图(Nomogram)预测模型,采用C指数、受试者工作特征(ROC)曲线和矫正曲线对模型准确性进行评价。
结果多因素Cox回归分析结果显示,年龄>80岁(HR=1.42,95%CI:1.15~1.76)、肿瘤分化程度为中分化或低分化或未分化(HR=3.96、4.24、3.03,95%CI:1.21~12.98、1.34~13.43、0.95~9.70)、N分期为Nx期(HR=1.25,95%CI:1.06~1.47)、阳性淋巴结检出数量≥10个(HR=1.44,95%CI:1.01~2.10)、骨转移(HR=1.42,95%CI:1.10~1.83)、肝转移(HR=1.28,95%CI:1.12~1.47)、糖类抗原125(CA125)升高(HR=1.89,95%CI:1.18~3.05)是患者总生存率的独立危险因素(P < 0.05),病理组织类型为Ⅱ型上皮性(HR=0.70,95%CI:0.52~0.92)、手术R0切除或其他手术方式(HR=0.40、0.54,95%CI:0.31~0.51、0.45~0.66)、化疗(HR=0.31,95%CI:0.26~0.36)、已婚状态(HR=0.86,95%CI:0.75~0.99)是患者总生存率的独立保护因素(P < 0.05);年龄>80岁、未手术、未化疗、肝转移、骨转移、CA125升高是患者癌症特异性生存率的独立危险因素(P < 0.05)。针对总生存率和癌症特异性生存率分别建立Nomogram预测模型,2种预测模型内部、外部验证的C指数分别为0.767、0.761和0.750、0.742,曲线下面积分别为0.775、0.783和0.749、0.764。
结论识别卵巢癌肺转移患者预后的独立影响因素并建立可以定量的可视化Nomogram预测模型,有助于临床医师更加准确地评估患者预后。
Abstract:ObjectiveTo investigate the independent prognostic factors for ovarian cancer patients with lung metastases based on the Surveillance, Epidemiology and End Results Database (SEER) of the United States and to establish a survival prediction model.
MethodsClinical data of 1 804 ovarian cancer patients diagnosed with lung metastases from 2010 to 2015 were collected, and they were divided into modeling set (1 203 cases) and validation set (601 cases) in a 2:1 ratio. Independent prognostic factors of ovarian cancer patients with lung metastasis were evaluated by Cox regression analysis and Nomogram prediction model was established. C index, receiver operating characteristic (ROC) curve and correction curve were used to evaluate the accuracy of the model.
ResultsMultivariate Cox regression analysis showed that age>80 years old (HR=1.42; 95%CI, 1.15 to 1.76), moderately or poorly differentiated or undifferentiated tumor (HR=3.96, 4.24, 3.03; 95%CI, 1.21 to 12.98, 1.34 to 13.43, 0.95 to 9.70), Nx stage of N stage (HR=1.25; 95%CI, 1.06 to 1.47), ten positive lymph nodes or more (HR=1.44, 95%CI, 1.01 to 2.10), bone metastasis (HR=1.42; 95%CI, 1.10 to 1.83), liver metastasis (HR=1.28; 95%CI, 1.12 to 1.47), elevated CA125 (HR=1.89; 95%CI, 1.18 to 3.05) were independent risk factors for overall survival (P < 0.05). The epithelial type II of histological type (HR=0.70; 95%CI, 0.52 to 0.92), surgical R0 resection or other surgical methods (HR=0.40, 0.54, 95%CI, 0.31 to 0.51, 0.45 to 0.66), chemotherapy (HR=0.31, 95%CI, 0.26 to 0.36) and married status (HR=0.86, 95%CI, 0.75 to 0.99) were independent protective factors for overall survival (P < 0.05). Age>80 years old, no surgery, no chemotherapy, liver metastasis, bone metastasis, and elevated cancer antigen-125 (CA125) were independent risk factors for cancer-specific survival (P < 0.05). Nomogram prediction models were established for the overall survival rate and cancer-specific survival rate, and the C index of internal and external verification were 0.767, 0.761 and 0.750, 0.742, and the areas under the curve were 0.775, 0.783 and 0.749, 0.764, respectively.
ConclusionIdentifying the independent prognostic factors of patients with ovarian cancer with lung metastasis and establishing a quantitative Nomogram prediction model will help clinicians evaluate the prognosis more accurately.
-
卵巢癌是妇科最常见的恶性肿瘤之一,也是导致女性癌症相关死亡的第5大原因[1]。尽管近年来手术技术(如腹腔镜技术和达芬奇机器人系统)和化疗技术进步巨大,但是卵巢癌患者的生存结局并无明显改善。相关研究[2]称,近70%患者确诊时已进入晚期并伴有远处转移,5年总生存率仅29%。另有研究[3]显示,仅19%卵巢癌患者可被早期诊断(Ⅰ~Ⅱ期), 53%卵巢癌患者于Ⅲ期时确诊,而此时可能已经发生腹腔转移。易转移、症状隐匿、缺乏有效筛查和治疗是造成晚期卵巢癌患者高病死率和不良预后的主要原因,而腹腔途径、淋巴途径和血液途径是卵巢癌发生转移的主要途径。肺转移是卵巢癌最常见的远处转移之一,能够扰乱正常肺功能,引发胸痛、咳嗽、呼吸困难、肺部感染甚至咯血,并最终导致死亡[4-5]。目前,卵巢癌肺转移患者预后的危险因素在人群水平上尚未得到很好的评估。与美国癌症联合委员会(AJCC)提出的传统TNM分期相比,列线图(Nomogram)能够充分结合多个预后影响因素(例如患者年龄、种族、组织病理类型、分化程度、是否手术治疗或放化疗等)而更好地量化个体生存风险,在癌症患者生存率评估方面具有重要价值[6-7]。尽管已有研究评估了卵巢癌肺转移的预后因素,但目前尚无公认的可以量化卵巢癌肺转移患者死亡风险的Nomogram模型。本研究基于美国监测、流行病学和最终结果数据库(SEER)收集大量卵巢癌肺转移患者的临床特征数据,评估患者预后相关流行病学特征和影响因素,建立Nomogram预测模型并加以验证,以期提高卵巢癌肺转移的临床诊治水平。
1. 资料与方法
1.1 一般资料
从SEER数据库中挑选2010—2015年符合世界卫生组织(WHO)国际疾病分类肿瘤学专辑第3版(ICD-O-3)中“ovary”定义的患者,排除年龄 < 20岁、通过尸检或死亡证明得到诊断、生存时间/转移状态未知的患者,本研究最终共纳入1 804例卵巢癌肺转移患者。根据年龄、诊断年份、种族、原发肿瘤部位、病理类型、肿瘤分化程度分级、T分期、N分期、是否手术、是否化疗、是否放疗、糖类抗原125(CA125)水平、区域淋巴结阳性数目、其他远处转移部位(脑、肝、骨)、肿瘤直径、婚姻状态等特征将队列进行分层,按2∶ 1比例分为建模集(1 203例)和验证集(601例)。
1.2 方法
采用多因素Cox回归分析评估卵巢癌肺转移患者预后的独立影响因素,并建立Nomogram预测模型。采用Fine-Gray竞争风险模型评估卵巢癌肺转移患者癌症特异性生存率相关因素,以累积发生率表示癌症相关死亡率和竞争风险死亡概率,并生成Kaplan-Meier生存曲线。使用SPSS 20.0软件(美国IBM公司)进行统计学分析,使用R软件(4.1.0版本)建立卵巢癌肺转移患者生存预测模型,并通过C指数、受试者工作特征(ROC)曲线和矫正曲线验证模型的稳定性和可靠性。
2. 结果
2.1 研究人群的临床特征
SEER数据库中, 2010—2015年共确诊41 387例卵巢癌患者,其中伴有肺转移者1 956例(4.73%), 按照排除标准剔除152例不符合要求的患者后,最终共纳入1 804例患者,并按照2∶ 1比例分为建模集(1 203例)和验证集(601例)。建模集与验证集卵巢癌肺转移患者的临床特征比较,差异均无统计学意义(P>0.05), 见表 1。
表 1 建模集与验证集卵巢癌肺转移患者的临床特征比较例 变量 分类 建模集(n=1 203) 验证集(n=601) χ2 P 年龄 < 60岁 350 167 0.41 0.82 60~80岁 633 319 >80岁 220 115 诊断年份 2010年 210 102 3.89 0.57 2011年 178 93 2012年 226 100 2013年 172 103 2014年 193 100 2015年 224 103 种族 白种人 970 470 1.58 0.46 黑种人 141 77 其他 92 54 原发肿瘤部位 左侧 204 100 4.62 0.20 右侧 189 112 双侧 378 164 不详 432 225 分化程度 Ⅰ级高分化 10 5 2.07 0.56 Ⅱ级中分化 43 17 Ⅲ级低分化 260 108 Ⅳ级未分化 176 92 T分期 T0~T1期 89 44 3.56 0.31 T2期 127 54 T3期 700 337 TX期 287 166 N分期 N0期 598 279 1.93 0.38 N1期 346 189 NX期 259 133 组织类型 Ⅰ型上皮性 73 43 1.27 0.53 Ⅱ型上皮性 1 061 519 非上皮性 69 39 手术 未手术 654 351 4.31 0.23 非R0切除 34 17 R0切除 155 81 其他 360 152 化疗 否/未知 353 187 0.60 0.44 是 850 414 放疗 否/未知 1 173 585 0.05 0.83 是 30 16 阳性淋巴结检出数量 < 10个 197 87 1.09 0.58 ≥10个 39 20 未知 967 494 骨转移 否 1 129 559 0.46 0.49 是 74 42 脑转移 否 1 182 589 0.11 0.74 是 21 12 肝转移 否 850 436 0.70 0.40 是 353 165 肿瘤直径 < 6 cm 210 92 3.02 0.39 6~12 cm 241 127 >12 cm 162 95 未知 590 287 婚姻状态 未婚 237 126 1.45 0.84 已婚 518 266 离异/分居 146 71 丧偶 253 118 未知 49 20 CA125 正常 23 10 0.72 0.70 升高 916 450 未知 264 141 CA125: 糖类抗原125。分化程度中,建模集有714例患者分化程度未知,未列出; 验证集有379例患者分化程度未知,未列出。 2.2 卵巢癌肺转移患者总生存率的影响因素分析
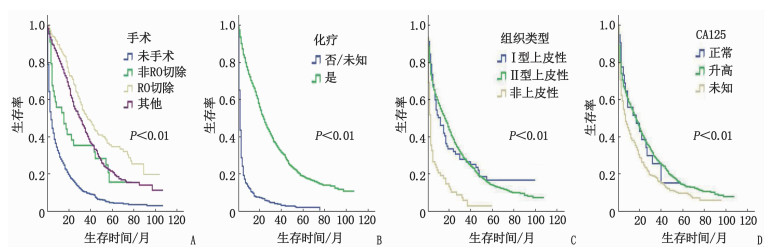
多因素Cox回归分析结果显示,年龄>80岁(与 <60岁相比, HR=1.42, 95%CI: 1.15~1.76, P < 0.01)、肿瘤分化程度为中分化(与高分化相比, HR=3.96, 95%CI: 1.21~12.98, P=0.02)、肿瘤分化程度为低分化(与高分化相比, HR=4.24, 95%CI: 1.34~13.43, P=0.01)、肿瘤分化程度为未分化(与高分化相比, HR=3.03, 95%CI: 0.95~9.70, P=0.06)、N分期为Nx期(与N0期相比, HR=1.25, 95%CI: 1.06~1.47, P=0.01)、阳性淋巴结检出数量≥ 10个(与 <10个相比, HR=1.44, 95%CI: 1.01~2.10, P=0.04)、骨转移(与无骨转移相比, HR=1.42, 95%CI: 1.10~1.83, P=0.01)、肝转移(与无肝转移相比, HR=1.28, 95%CI: 1.12~ 1.47, P < 0.01)、CA125升高(与正常相比, HR=1.89, 95%CI: 1.18~3.05, P=0.01)是卵巢癌肺转移患者总生存率的独立危险因素,病理组织类型为Ⅱ型上皮性(与Ⅰ型上皮性相比, HR=0.70, 95%CI: 0.52~0.92, P=0.01)、手术R0切除(与未手术相比, HR=0.40, 95%CI: 0.31~0.51, P < 0.01)、其他手术方式(与未手术相比, HR=0.54, 95%CI: 0.45~0.66, P < 0.01)、化疗(与未化疗相比, HR=0.31, 95%CI: 0.26~0.36, P < 0.01)、已婚状态(与未婚状态相比, HR=0.86, 95%CI: 0.75~0.99, P=0.04)是卵巢癌肺转移患者总生存率的独立保护因素,见表 2。根据手术、化疗、组织类型、CA125水平绘制生存曲线,见图 1。
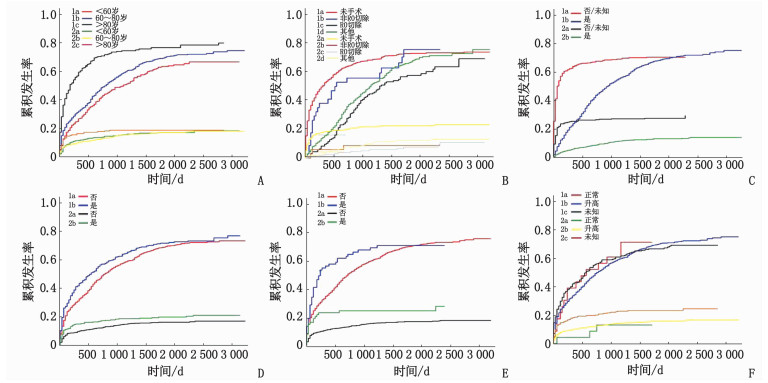
表 2 卵巢癌肺转移患者总生存率影响因素的Cox回归分析因素 分类 单因素分析 多因素分析 HR(95%CI) P HR(95%CI) P 年龄 < 60岁 1.00 — 1.00 — 60~80岁 1.22(1.06~1.41) 0.01 1.07(0.92~1.24) 0.41 >80岁 2.53(2.11~3.04) < 0.01 1.42(1.15~1.76) < 0.01 种族 白种人 1.00 — — — 黑种人 1.25(1.04~1.52) 0.02 — — 其他 0.79(0.62~1.01) 0.06 — — 原发肿瘤部位 左侧 1.00 — — — 右侧 0.97(0.78~1.21) 0.80 1.00 — 双侧 1.19(1.01~1.41) 0.04 — — 未知 2.14(1.46~3.14) < 0.01 — — 分化程度 Ⅰ级高分化 1.00 — 1.00 — Ⅱ级中分化 3.48(1.07~11.31) 0.04 3.96(1.21~12.98) 0.02 Ⅲ级低分化 3.63(1.16~11.36) 0.03 4.24(1.34~13.43) 0.01 Ⅳ级未分化 2.70(0.86~8.48) 0.09 3.03(0.95~9.70) 0.06 T分期 T0~T1期 1.00 — 1.00 — T2期 0.83(0.62~1.12) 0.22 — — T3期 0.71(0.56~1.01) 0.06 — — TX期 1.30(1.01~1.68) 0.04 — — N分期 N0期 1.00 — 1.00 — N1期 1.10(0.96~1.27) 0.18 1.14(0.97~1.33) 0.11 NX期 1.90(1.63~2.23) < 0.01 1.25(1.06~1.47) 0.01 组织类型 Ⅰ型上皮性 1.00 — 1.00 — Ⅱ型上皮性 1.02(0.78~1.32) 0.90 0.70(0.52~0.92) 0.01 非上皮性 2.46(1.73~3.49) < 0.01 1.01(0.68~1.45) 0.99 手术 未手术 1.00 — 1.00 — 非R0切除 0.45(0.31~0.66) < 0.01 0.73(0.49~1.10) 0.13 R0切除 0.26(0.21~0.32) < 0.01 0.40(0.31~0.51) < 0.01 其他 0.35(0.31~0.41) < 0.01 0.54(0.45~0.66) < 0.01 化疗 否/未知 1.00 — 1.00 — 是 0.22(0.19~0.25) < 0.01 0.31(0.26~0.36) < 0.01 放疗 否/未知 1.00 — 1.00 — 是 1.51(1.04~2.18) 0.05 — — 阳性淋巴结检出数量 < 10个 1.00 — 1.00 — ≥10个 1.82(1.26~2.63) 0.001 1.44(1.01~2.10) 0.04 骨转移 否 1.00 — 1.00 — 是 1.95(1.53~2.50) < 0.01 1.42(1.10~1.83) 0.01 肝转移 否 1.00 — 1.00 — 是 1.38(1.21~1.57) < 0.01 1.28(1.12~1.47) < 0.01 肿瘤直径 < 6 cm 1.00 — 1.00 — 6~12 cm 1.04(0.85~1.27) 0.73 — — >12 cm 1.10(0.88~1.38) 0.40 — — 婚姻状态 未婚 1.00 — 1.00 — 已婚 0.77(0.65~0.92) < 0.01 0.86(0.75~0.99) 0.04 离异/分居 1.18(0.95~1.47) 0.14 1.14(0.95~1.37) 0.15 丧偶 1.45(1.20~1.75) < 0.01 1.09(1.01~1.21) 0.09 CA125 正常 1.00 — 1.00 — 升高 0.97(0.61~1.53) 0.89 1.89(1.18~3.05) 0.01 未知 1.36(0.85~2.16) 0.20 1.74(1.06~2.83) 0.03 单因素Cox回归分析中仅列出结果有意义(P < 0.05)的因素。 其他原因引起的死亡可能会使预后评估结果出现偏差,故本研究采用Fine-Gray竞争风险模型对卵巢癌肺转移患者癌症特异性生存率的影响因素进行分析,见图 2。逐步筛选后进行多因素Cox回归分析,结果显示,年龄>80岁、未手术、未化疗、肝转移、骨转移、CA125升高为卵巢癌肺转移患者癌症特异性生存率的独立危险因素,见表 3。
表 3 卵巢癌肺转移患者癌症特异性生存率的多因素Cox回归分析因素 分类 HR 95%CI P 年龄 < 60岁 1.00 — — 60~80岁 1.09 0.93~1.29 0.30 >80岁 1.52 1.22~1.89 < 0.01 手术 未手术 1.00 — — 非R0切除 0.73 0.48~1.11 0.14 R0切除 0.43 0.34~0.56 < 0.01 其他 0.56 0.47~0.68 < 0.01 化疗 否/未知 1.00 — — 是 0.35 0.29~0.41 < 0.01 骨转移 否 1.00 — — 是 1.37 1.03~1.83 0.03 肝转移 否 1.00 — — 是 1.31 1.13~1.52 < 0.01 CA125 正常 1.00 — — 升高 1.78 1.15~2.75 0.01 未知 1.57 1.01~2.46 0.04 2.3 卵巢癌肺转移患者生存率预测模型的建立
根据建模集多因素Cox回归分析结果,将差异有统计学意义的10个因素纳入总生存率Nomogram预测模型,用于预测患者1、3、5年生存率,见图 3A。根据建模集多因素Cox回归分析结果和Fine-Gray竞争风险模型分析结果,将差异有统计学意义的6个因素纳入癌症特异性生存率Nomogram预测模型,用于预测患者1、3、5年生存率,见图 3B。
2.4 卵巢癌肺转移患者生存率预测模型的评价
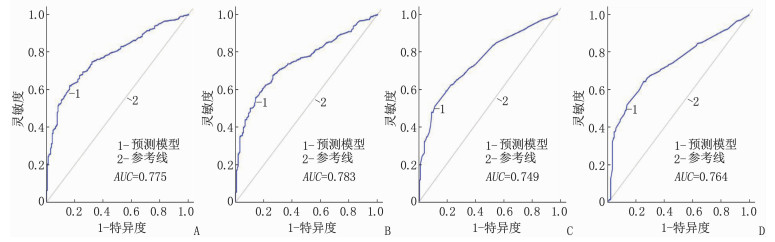
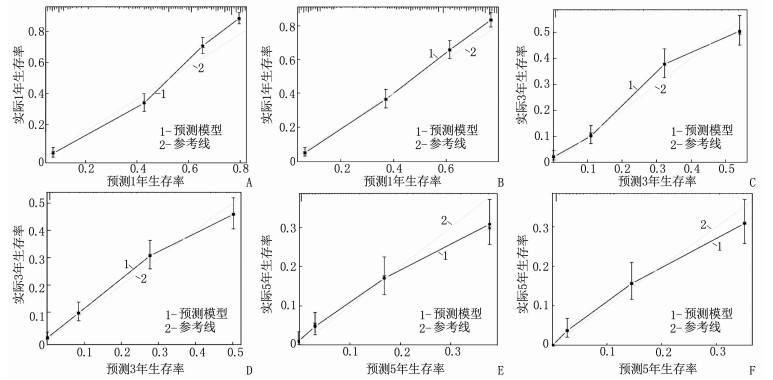
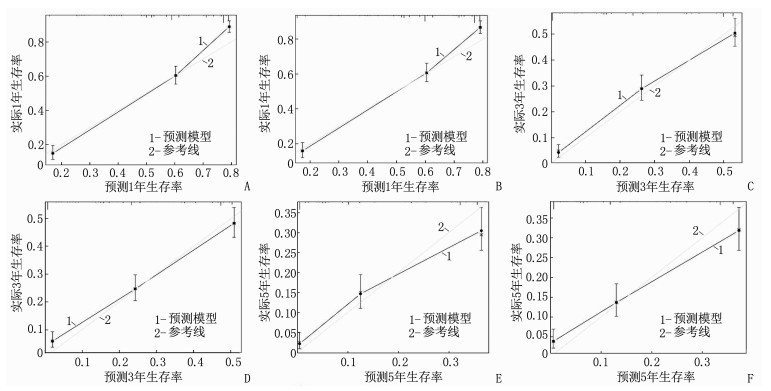
总生存率Nomogram预测模型和癌症特异性生存率Nomogram预测模型的内部、外部验证的C指数分别为0.767(95%CI: 0.754~0.780)、0.761(95%CI: 0.748~0.774)和0.750(95%CI: 0.737~0.764)、0.742(95%CI: 0.729~0.756); 总生存率Nomogram预测模型和癌症特异性生存率Nomogram预测模型内部、外部验证的曲线下面积(AUC)分别为0.775、0.783和0.749、0.764, 见图 4。无论是内部验证还是外部验证,1、3、5年矫正曲线均显示预测生存率与实际生存率具有高度一致性,说明本研究建立的2个预测模型具有高度的辨别能力和准确性,见图 5、图 6。
3. 讨论
既往研究[7-8]报道了上皮性卵巢癌肺转移患者预后的独立危险因素,本研究则基于卵巢癌全部病理类型进行回顾性研究,并量化分析卵巢癌肺转移患者癌症特异性死亡的独立危险因素。本研究建立Nomogram模型对SEER数据库中与卵巢癌肺转移患者预后相关的独立危险因素进行可视化分析,并探讨竞争风险事件存在情况下关键的预后危险因素,该模型在预测患者生存率方面显示出良好的准确性和一致性,可为预后判断提供关键信息,有利于个体化治疗方案的选择。本研究结果显示,年龄、组织类型、N分期、化疗、手术、骨转移、肝转移、CA125、婚姻状态和区域淋巴结阳性数量均与卵巢癌肺转移患者预后相关。由于突变的积累和免疫系统的受损,衰老被认为是癌症的最大风险因素,老年卵巢癌患者的总生存期较短,不受分期和组织学亚型的影响。本研究发现,随着年龄的增长,患者预后越来越差,进一步证明年龄是宫颈癌预后的独立影响因素。根据不同的分子生物学特点和病理学形态,上皮性卵巢癌可分为Ⅰ型和Ⅱ型上皮性肿瘤,其中Ⅰ型上皮性肿瘤包括内膜样癌、透明细胞癌、浆液性癌、黏液性癌和移行细胞癌,Ⅱ型上皮性肿瘤主要包括未分化癌、高级别浆液性癌和癌肉瘤[9-10]。虽然Ⅱ型上皮性肿瘤通常表现出更强的侵袭性和更差的预后[10-11],但另一项基于SEER数据库的涉及10 383名研究对象的研究[12]称,多因素Cox回归分析显示Ⅱ型上皮细胞性肿瘤与卵巢癌患者的良好预后相关(与Ⅰ型上皮细胞性肿瘤相比, HR=0.78, 95%CI: 0.70~0.86, P < 0.001)。本研究亦发现,在卵巢癌肺转移患者中,Ⅱ型上皮性肿瘤的预后更好(与Ⅰ型上皮性相比, HR=0.70, 95%CI: 0.52~0.92, P=0.01), 但其生物学机制尚需进一步研究。
目前, CA125在肿瘤发生、转移和靶向治疗中的作用已得到广泛关注, CA125可分别与间皮素、β-catenin表达和p120连环蛋白(p120ctn)易位之间发生相互作用而促进转移过程, E-cadherin表达的减少也参与了肿瘤细胞的形态变化和肿瘤的发生。此外, CA125可诱导自然杀伤细胞功能衰减和Treg细胞富集,促进癌细胞的免疫逃逸[3]。美国食品药品管理局(FDA)建议应用CA125水平反映治疗效果,或监测一线治疗后的病灶残留或复发风险。血清CA125水平已被证实与临床分期及生存率相关[13],还有研究[14-15]称术后或化疗后CA125水平过高与预后不良相关。本研究结果亦显示, CA125水平正常的患者预后较好,生存率更高。值得注意的是, CA125水平并不能充分反映肿瘤状态,因为非肿瘤细胞(如间皮细胞)也会在促炎环境(如腹水)中分泌CA125[14]。
尽管近年来卵巢癌的内科和外科治疗策略不断发展,但细胞毒性化疗和手术治疗仍然是当前治疗卵巢癌的主要手段,且是否化疗和是否手术对患者预后影响较大。DU BOIS A等[16]回顾AGO研究数据发现,与R0切除相比,肿瘤残留1~10 mm患者总生存率下降了2.7倍,与肿瘤残留超过1 cm的患者相比,肿瘤残留1~10 mm的患者有近7个月的生存优势,表明患者可从最大程度肿瘤切除中获益。KEYVER-PAIK M D等[17]对来自3个中心的1 000多例卵巢癌进行评估,结果显示,晚期卵巢癌(FIGO分期Ⅱ~Ⅳ期)的R0切除率超过了60%。有研究[18]指出,晚期卵巢癌的标准化疗包括6个周期的卡铂AUC5和紫杉醇175 mg/m2, 每3周为1个周期。然而,顺铂类药物和紫衫醇类药物易发生耐药反应(耐药机制主要包括凋亡途径、多耐药基因、肿瘤微环境和非编码RNA等生物进程),因此,目前常用的卵巢癌治疗手段(手术联合化疗为主)效果并不理想,肿瘤复发率较高。SOLO1试验将奥拉帕尼作为一线维持疗法单用药物,可使BRCA基因突变的卵巢癌患者的疾病进展风险降低70%[18]。
关于婚姻对疾病的益处现已有许多解释,且其也适用于癌症患者。对于患者而言,确诊癌症可能带来比确诊其他疾病更多的痛苦[19], 婚姻的存在则可在一定程度上给予患者社会支持,不仅能改善患者的预后,而且能平缓患者确诊后的负面情绪(如痛苦、抑郁和焦虑等),其重要原因之一是伴侣可以分担负担且提供一定的社会、经济支持。SIN N L等[20]证实抑郁症与非依从性存在相关性,而提升患者对治疗方案和医嘱的依从性可改善患者预后[21]。另外,已婚女性定期接受癌症筛查,可大大提高早期癌症检出率,从而积极寻求医疗救助。AIZER A A等[22]研究表明,虽然调整了一些已知的复杂因素,但是未婚癌症患者仍然存在较高的转移和死亡风险。丧偶患者预后最差可能与以下因素有关: 首先,丧偶患者确诊癌症后,更复杂的精神因素和心理压力可能使其更容易发生抑郁症[23], 加之其获得的照顾较少,故而病死率升高[24]; 其次,丧偶患者可能不会关注自身健康状况[25], 使得卵巢癌患病风险增加; 再次,老年人免疫力较低[26], 而心理支持的减少会改变人体免疫功能,削弱机体抑制肿瘤进展的作用,导致丧偶患者生存期缩短[27]; 最后,丧偶患者很可能超过60岁,而年龄会影响治疗方案的选择[28], 老年患者通常倾向于选择保守治疗。因此,政策制定者应该努力改善处于不良婚姻状态(包括丧偶、未婚、离婚/分居)的卵巢癌患者各方面的社会支持状况。
Nomogram模型可帮助医生进行临床决策,而基于临床特征的预后评估可能在精准医疗时代发挥关键作用。但本研究存在一些局限性: ①部分患者的死亡很难确定是否与宫颈癌有关,这会对癌症特异性死亡分析造成不良影响; ②SEER数据库主要收录美国癌症患者的详细信息,难免存在种族偏差; ③SEER数据库未记录详细治疗方案、是否复发、并发症等显著影响预后的因素信息,这可能在很大程度上影响本研究建立模型在实际病例中的适用性,故分析结果时应谨慎解读。
综上所述,筛选出卵巢癌肺转移患者预后的独立影响因素并建立可以定量的可视化Nomogram预测模型,有助于临床医师更加准确地预测患者的生存率。
-
表 1 建模集与验证集卵巢癌肺转移患者的临床特征比较
例 变量 分类 建模集(n=1 203) 验证集(n=601) χ2 P 年龄 < 60岁 350 167 0.41 0.82 60~80岁 633 319 >80岁 220 115 诊断年份 2010年 210 102 3.89 0.57 2011年 178 93 2012年 226 100 2013年 172 103 2014年 193 100 2015年 224 103 种族 白种人 970 470 1.58 0.46 黑种人 141 77 其他 92 54 原发肿瘤部位 左侧 204 100 4.62 0.20 右侧 189 112 双侧 378 164 不详 432 225 分化程度 Ⅰ级高分化 10 5 2.07 0.56 Ⅱ级中分化 43 17 Ⅲ级低分化 260 108 Ⅳ级未分化 176 92 T分期 T0~T1期 89 44 3.56 0.31 T2期 127 54 T3期 700 337 TX期 287 166 N分期 N0期 598 279 1.93 0.38 N1期 346 189 NX期 259 133 组织类型 Ⅰ型上皮性 73 43 1.27 0.53 Ⅱ型上皮性 1 061 519 非上皮性 69 39 手术 未手术 654 351 4.31 0.23 非R0切除 34 17 R0切除 155 81 其他 360 152 化疗 否/未知 353 187 0.60 0.44 是 850 414 放疗 否/未知 1 173 585 0.05 0.83 是 30 16 阳性淋巴结检出数量 < 10个 197 87 1.09 0.58 ≥10个 39 20 未知 967 494 骨转移 否 1 129 559 0.46 0.49 是 74 42 脑转移 否 1 182 589 0.11 0.74 是 21 12 肝转移 否 850 436 0.70 0.40 是 353 165 肿瘤直径 < 6 cm 210 92 3.02 0.39 6~12 cm 241 127 >12 cm 162 95 未知 590 287 婚姻状态 未婚 237 126 1.45 0.84 已婚 518 266 离异/分居 146 71 丧偶 253 118 未知 49 20 CA125 正常 23 10 0.72 0.70 升高 916 450 未知 264 141 CA125: 糖类抗原125。分化程度中,建模集有714例患者分化程度未知,未列出; 验证集有379例患者分化程度未知,未列出。 表 2 卵巢癌肺转移患者总生存率影响因素的Cox回归分析
因素 分类 单因素分析 多因素分析 HR(95%CI) P HR(95%CI) P 年龄 < 60岁 1.00 — 1.00 — 60~80岁 1.22(1.06~1.41) 0.01 1.07(0.92~1.24) 0.41 >80岁 2.53(2.11~3.04) < 0.01 1.42(1.15~1.76) < 0.01 种族 白种人 1.00 — — — 黑种人 1.25(1.04~1.52) 0.02 — — 其他 0.79(0.62~1.01) 0.06 — — 原发肿瘤部位 左侧 1.00 — — — 右侧 0.97(0.78~1.21) 0.80 1.00 — 双侧 1.19(1.01~1.41) 0.04 — — 未知 2.14(1.46~3.14) < 0.01 — — 分化程度 Ⅰ级高分化 1.00 — 1.00 — Ⅱ级中分化 3.48(1.07~11.31) 0.04 3.96(1.21~12.98) 0.02 Ⅲ级低分化 3.63(1.16~11.36) 0.03 4.24(1.34~13.43) 0.01 Ⅳ级未分化 2.70(0.86~8.48) 0.09 3.03(0.95~9.70) 0.06 T分期 T0~T1期 1.00 — 1.00 — T2期 0.83(0.62~1.12) 0.22 — — T3期 0.71(0.56~1.01) 0.06 — — TX期 1.30(1.01~1.68) 0.04 — — N分期 N0期 1.00 — 1.00 — N1期 1.10(0.96~1.27) 0.18 1.14(0.97~1.33) 0.11 NX期 1.90(1.63~2.23) < 0.01 1.25(1.06~1.47) 0.01 组织类型 Ⅰ型上皮性 1.00 — 1.00 — Ⅱ型上皮性 1.02(0.78~1.32) 0.90 0.70(0.52~0.92) 0.01 非上皮性 2.46(1.73~3.49) < 0.01 1.01(0.68~1.45) 0.99 手术 未手术 1.00 — 1.00 — 非R0切除 0.45(0.31~0.66) < 0.01 0.73(0.49~1.10) 0.13 R0切除 0.26(0.21~0.32) < 0.01 0.40(0.31~0.51) < 0.01 其他 0.35(0.31~0.41) < 0.01 0.54(0.45~0.66) < 0.01 化疗 否/未知 1.00 — 1.00 — 是 0.22(0.19~0.25) < 0.01 0.31(0.26~0.36) < 0.01 放疗 否/未知 1.00 — 1.00 — 是 1.51(1.04~2.18) 0.05 — — 阳性淋巴结检出数量 < 10个 1.00 — 1.00 — ≥10个 1.82(1.26~2.63) 0.001 1.44(1.01~2.10) 0.04 骨转移 否 1.00 — 1.00 — 是 1.95(1.53~2.50) < 0.01 1.42(1.10~1.83) 0.01 肝转移 否 1.00 — 1.00 — 是 1.38(1.21~1.57) < 0.01 1.28(1.12~1.47) < 0.01 肿瘤直径 < 6 cm 1.00 — 1.00 — 6~12 cm 1.04(0.85~1.27) 0.73 — — >12 cm 1.10(0.88~1.38) 0.40 — — 婚姻状态 未婚 1.00 — 1.00 — 已婚 0.77(0.65~0.92) < 0.01 0.86(0.75~0.99) 0.04 离异/分居 1.18(0.95~1.47) 0.14 1.14(0.95~1.37) 0.15 丧偶 1.45(1.20~1.75) < 0.01 1.09(1.01~1.21) 0.09 CA125 正常 1.00 — 1.00 — 升高 0.97(0.61~1.53) 0.89 1.89(1.18~3.05) 0.01 未知 1.36(0.85~2.16) 0.20 1.74(1.06~2.83) 0.03 单因素Cox回归分析中仅列出结果有意义(P < 0.05)的因素。 表 3 卵巢癌肺转移患者癌症特异性生存率的多因素Cox回归分析
因素 分类 HR 95%CI P 年龄 < 60岁 1.00 — — 60~80岁 1.09 0.93~1.29 0.30 >80岁 1.52 1.22~1.89 < 0.01 手术 未手术 1.00 — — 非R0切除 0.73 0.48~1.11 0.14 R0切除 0.43 0.34~0.56 < 0.01 其他 0.56 0.47~0.68 < 0.01 化疗 否/未知 1.00 — — 是 0.35 0.29~0.41 < 0.01 骨转移 否 1.00 — — 是 1.37 1.03~1.83 0.03 肝转移 否 1.00 — — 是 1.31 1.13~1.52 < 0.01 CA125 正常 1.00 — — 升高 1.78 1.15~2.75 0.01 未知 1.57 1.01~2.46 0.04 -
[1] FERLAY J, STELIAROVA-FOUCHER E, LORTET-TIEULENT J, et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012[J]. Eur J Cancer, 2013, 49(6): 1374-1403. doi: 10.1016/j.ejca.2012.12.027
[2] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA A Cancer J Clin, 2019, 69(1): 7-34. doi: 10.3322/caac.21551
[3] ZHANG M H, CHENG S S, JIN Y, et al. Roles of CA125 in diagnosis, prediction, and oncogenesis of ovarian cancer[J]. Biochim Biophys Acta BBA Rev Cancer, 2021, 1875(2): 188503. doi: 10.1016/j.bbcan.2021.188503
[4] PROCACCIO L, BERGAMO F, MANAI C, et al. An overview on clinical, pathological and molecular features of lung metastases from colorectal cancer[J]. Expert Rev Respir Med, 2019, 13(7): 635-644. doi: 10.1080/17476348.2019.1620605
[5] LUTZ S, NORRELL R, BERTUCIO C, et al. Symptom frequency and severity in patients with metastatic or locally recurrent lung cancer: a prospective study using the Lung Cancer Symptom Scale in a community hospital[J]. J Palliat Med, 2001, 4(2): 157-165. doi: 10.1089/109662101750290191
[6] BALACHANDRAN V P, GONEN M, SMITH J J, et al. Nomograms in oncology: more than meets the eye[J]. Lancet Oncol, 2015, 16(4): e173-e180. doi: 10.1016/S1470-2045(14)71116-7
[7] XU J Q, HUSSAIN I, WANG L Y, et al. Incidence of and risk factors associated with lung metastases in newly diagnosed epithelial ovarian cancer with a look on prognosis after diagnosis: a population-based cohort study of the SEER database[J]. Arch Gynecol Obstet, 2021, 304(4): 1007-1020. doi: 10.1007/s00404-021-05997-w
[8] YUAN Y F, GUO F F, WANG R R, et al. Development and validation of a nomogram to predict synchronous lung metastases in patients with ovarian cancer: a large cohort study[J]. Biosci Rep, 2020, 40(11): BSR20203089. doi: 10.1042/BSR20203089
[9] PERES L C, CUSHING-HAUGEN K L, KÖBEL M, et al. Invasive epithelial ovarian cancer survival by histotype and disease stage[J]. J Natl Cancer Inst, 2019, 111(1): 60-68. doi: 10.1093/jnci/djy071
[10] MATZ M, COLEMAN M P, SANT M, et al. The histology of ovarian cancer: worldwide distribution and implications for international survival comparisons (CONCORD-2)[J]. Gynecol Oncol, 2017, 144(2): 405-413. doi: 10.1016/j.ygyno.2016.10.019
[11] KURMAN R J, SHIH I M. The dualistic model of ovarian carcinogenesis: revisited, revised, and expanded[J]. Am J Pathol, 2016, 186(4): 733-747. doi: 10.1016/j.ajpath.2015.11.011
[12] 符伶俐, 韩江龙, 付振明. 年轻卵巢癌患者的临床特征及影响生存结局的因素: 一项人群队列回顾性研究[J]. 临床与病理杂志, 2021, 41(10): 2274-2284. doi: 10.3978/j.issn.2095-6959.2021.10.008 [13] COOPER B C, SOOD A K, DAVIS C S, et al. Preoperative CA 125 levels: an independent prognostic factor for epithelial ovarian cancer[J]. Obstet Gynecol, 2002, 100(1): 59-64.
[14] MATTE I, GARDE-GRANGER P, BESSETTE P, et al. Ascites from ovarian cancer patients stimulates MUC16 mucin expression and secretion in human peritoneal mesothelial cells through an Akt-dependent pathway[J]. BMC Cancer, 2019, 19(1): 406. doi: 10.1186/s12885-019-5611-7
[15] LEE M, CHANG M Y, YOO H, et al. Clinical significance of CA125 level after the first cycle of chemotherapy on survival of patients with advanced ovarian cancer[J]. Yonsei Med J, 2016, 57(3): 580-587. doi: 10.3349/ymj.2016.57.3.580
[16] DU BOIS A, REUSS A, PUJADE-LAURAINE E, et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials: by the Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) and the Groupe d'Investigateurs Nationaux Pour les Etudes des Cancers de l'Ovaire (GINECO)[J]. Cancer, 2009, 115(6): 1234-1244. doi: 10.1002/cncr.24149
[17] KEYVER-PAIK M D, ABRAMIAN A, DOMRÖSE C, et al. Integrated care in ovarian cancer "IgV Ovar": results of a German pilot for higher quality in treatment of ovarian cancer[J]. J Cancer Res Clin Oncol, 2016, 142(2): 481-487. doi: 10.1007/s00432-015-2055-6
[18] FRIEDRICH M, FRIEDRICH D, KRAFT C, et al. Multimodal treatment of primary advanced ovarian cancer[J]. Anticancer Res, 2021, 41(7): 3253-3260. doi: 10.21873/anticanres.15111
[19] KAISER N C, HARTOONIAN N, OWEN J E. Toward a cancer-specific model of psychological distress: population data from the 2003-2005 National Health Interview Surveys[J]. J Cancer Surviv, 2010, 4(4): 291-302. doi: 10.1007/s11764-010-0120-3
[20] SIN N L, DIMATTEO M R. Depression treatment enhances adherence to antiretroviral therapy: a meta-analysis[J]. ann behav med, 2014, 47(3): 259-269. doi: 10.1007/s12160-013-9559-6
[21] COHEN S D, SHARMA T, ACQUAVIVA K, et al. Social support and chronic kidney disease: an update[J]. Adv Chronic Kidney Dis, 2007, 14(4): 335-344. doi: 10.1053/j.ackd.2007.04.007
[22] AIZER A A, CHEN M H, MCCARTHY E P, et al. Marital status and survival in patients with cancer[J]. J Clin Oncol, 2013, 31(31): 3869-3876. doi: 10.1200/JCO.2013.49.6489
[23] SATIN J R, LINDEN W, PHILLIPS M J. Depression as a predictor of disease progression and mortality in cancer patients: a meta-analysis[J]. Cancer, 2009, 115(22): 5349-5361. doi: 10.1002/cncr.24561
[24] GE L X, MORDIFFI S Z. Factors associated with higher caregiver burden among family caregivers of elderly cancer patients: a systematic review[J]. Cancer Nurs, 2017, 40(6): 471-478. doi: 10.1097/NCC.0000000000000445
[25] KIM A, LEE J A, PARK H S. Health behaviors and illness according to marital status in middle-aged Koreans[J]. J Public Health (Oxf), 2018, 40(2): e99-e106. doi: 10.1093/pubmed/fdx071
[26] FRANCESCHI C, CAPRI M, MONTI D, et al. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans[J]. Mech Ageing Dev, 2007, 128(1): 92-105. doi: 10.1016/j.mad.2006.11.016
[27] GARSSEN B, GOODKIN K. On the role of immunological factors as mediators between psychosocial factors and cancer progression[J]. Psychiatry Res, 1999, 85(1): 51-61. doi: 10.1016/S0165-1781(99)00008-6
[28] SERRA-REXACH J A, JIMENEZ A B, GARCÍA-ALHAMBRA M A, et al. Differences in the therapeutic approach to colorectal cancer in young and elderly patients[J]. Oncologist, 2012, 17(10): 1277-1285. doi: 10.1634/theoncologist.2012-0060
-
期刊类型引用(7)
1. 李晗静,周卫鹏. 急性缺血性脑卒中康复无效的风险预测Nomogram模型构建及验证. 中国疗养医学. 2025(01): 15-21 .  百度学术
百度学术
2. 代佳,付茸,王一羽,燕林青,康毓芝. 异体输血治疗对围术期卵巢癌患者免疫功能及免疫指标的影响. 中国妇幼保健. 2025(03): 506-509 .  百度学术
百度学术
3. 李芬,冯晓丽,韩春韬. 基于临床特征和肿瘤标志物预测卵巢癌近期预后不良的风险模型研究. 临床研究. 2025(03): 76-81 .  百度学术
百度学术
4. 丁琨,赵蕾,程亚玉,赵淑萍. 基于SEER数据库相关数据构建老年女性卵巢癌不良预后预测模型. 山东医药. 2024(12): 60-64 .  百度学术
百度学术
5. 曹铁凤,黄佳明,肖丽薇,何雨诗,沈慧敏. 基于SEER数据库的早期卵巢癌患者切除淋巴结后生存列线图模型构建. 西部医学. 2024(09): 1303-1307+1312 .  百度学术
百度学术
6. 刘丽丽,杨莉莉,吴风华. 血清糖类抗原125和25-羟维生素D对宫颈癌患者预后的评估价值. 肿瘤基础与临床. 2023(06): 483-486 .  百度学术
百度学术
7. 秦秀丽. 超声成像联合血清AFP、TPS、NSE检测对卵巢癌的临床诊断价值. 影像研究与医学应用. 2023(16): 134-136 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号