Relationship between serum vitamin D metabolites and sleep duration among adult women
-
摘要:目的
探讨成年女性血清维生素D代谢物与睡眠时间的相关性。
方法选取美国国家健康与营养调查(NHANES)数据库中20~65岁的9 353例女性为研究对象,采用液相色谱-串联质谱法定量检测25-羟基维生素D[25(OH)D]、25-羟基维生素D2[25(OH)D2]及25-羟基维生素D3[25(OH)D3]等血清维生素D代谢物;按照睡眠时间不同将研究对象分为睡眠不足组和非睡眠不足组。调整年龄、种族、受教育程度、婚姻状况、经济状况、体质量指数(BMI)、慢性病状况和抑郁评分后,采用Logistic回归模型结合限制性立方样条模型分析血清维生素D浓度与睡眠时间的关联性。
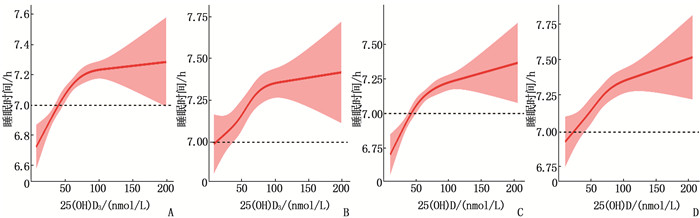
结果9 353例女性研究对象中,3 189例(34.1%)女性睡眠不足,包括20~44岁女性1 627例(51.0%)和45~65岁女性1 562例(49.0%)。血清25(OH)D3及25(OH)D每增加10 nmol/L,睡眠不足的发生率分别下降5.5%与5.7%[OR=1.005 5,95%CI为1.003 6~1.007 3;OR=1.005 7,95%CI为1.003 9~1.007 6]。限制性立方样条模型显示,当血清25(OH)D3≤70 nmol/L时,睡眠时间随着血清25(OH)D3浓度的升高而延长,呈较强的正相关;当血清25(OH)D3>70 nmol/L时,正相关关系变弱。
结论成年女性睡眠状况与体内血清维生素D代谢物浓度存在相关性,且不同维生素D浓度的女性睡眠时间不同。当血清维生素D代谢物浓度较低时,提高维生素D代谢物的水平更有助于睡眠时间的延长。
-
关键词:
- 睡眠时间 /
- 女性 /
- 维生素D /
- 25-羟基维生素D /
- 25-羟基维生素D3
Abstract:ObjectiveTo explore the association between serum vitamin D metabolites and sleep duration in adult women.
MethodsWomen aged 20 to 65 in the National Health and Nutrition Examination Survey (NHANES) database were selected as research objects. Serum vitamin D metabolites including 25-hydroxyvitamin D[25(OH)D], 25-hydroxyvitamin D2[25(OH)D2] and 25-hydroxyvitamin D3[25(OH)D3] were measured using ultra performance liquid chromatography-tandem mass spectrometry. The study objects were divided into sleep deficiency group and non-sleep deficiency group according to varied sleep duration. Logistic regression model and restrictive cubic spline model were used to analyze the relationship between serum vitamin D concentration and sleep condition after adjusting age, race, education level, marital status, economic status, body mass index(BMI), chronic disease status and depression score.
ResultsAmong 9 353 females, 3 189 (34.1%) had insufficient sleep, including 1 627 (51.0%) aged 20 to 44 years and 1 562 (49.0%) aged 45 to 65 years. With an increase of 10 nmol/L of serum 25(OH)D3 and 25(OH)D, the incidence of sleep insufficiency decreased by 5.5% and 5.7%, respectively[OR=1.005 5, 95%CI, 1.003 6 to 1.007 3; OR=1.005 7, 95%CI, 1.003 9 to 1.007 6]. The restrictive cubic spline model showed that when serum 25(OH)D3 is ≤ 70 nmol/L, a strong positive correlation was observed between sleep duration and serum 25(OH)D3 concentration. However, this positive correlation becomes weaker when serum 25(OH)D3 was >70 nmol/L.
ConclusionThere is an association between the sleep status and the time of serum concentration of vitamin D metabolites in adult women. The sleep duration varies at different vitamin D concentration levels. When the concentration of serum vitamin D metabolites is low, improvement of level of vitamin D metabolites is more conducive to prolongation of sleep time.
-
Keywords:
- sleep duration /
- women /
- vitamin D /
- 25-hydroxyvitamin D /
- 25-hydroxyvitamin D3
-
心率变异性(HRV)作为一种可重复的无创检测指标,可反映自主神经系统对心血管系统的调控作用,且在预测猝死事件中起着关键作用[1-2]。HRV相关研究大多选取窦性心律人群作为研究对象,且排除心房颤动(简称房颤)患者,因此HRV在房颤患者中的作用目前尚未阐明[3]。房颤是65岁以上人群最常见的心律失常类型,超高龄(≥80岁)人群的房颤发病率则高达10%[4]。相关研究[3, 5]显示,房颤患者HRV降低与心力衰竭、年龄增长、心率过速、糖尿病等多重因素相关。研究[6]显示, β受体阻滞剂、非二氢吡啶类钙离子拮抗剂治疗可显著改善患者的HRV。本研究探讨超高龄持续性房颤患者HRV与可能影响自主神经系统活性的基础临床特征的关系,现报告如下。
1. 资料和方法
1.1 一般资料
选取2018年1月—2020年6月在江苏省人民医院住院的108例超高龄持续性房颤患者纳入房颤组,患者房颤发作持续时间>7 d, 病程>6个月。另选取127例超高龄窦性心律老人纳入对照组,其中男47例,女80例,平均年龄(88.01±4.61)岁。本研究经江苏省人民医院医学伦理委员会审批,且患者均签署知情同意书。
1.2 基础临床特征
房颤患者的基础临床特征包括基础疾病(共病)和正在服用的药物; 共病包括高血压(符合高血压诊断标准[7], 接受常规降压治疗)、糖尿病(符合糖尿病诊断标准[8])、冠心病(既往有急性心肌梗死史、冠状动脉支架或主动脉-冠状动脉旁路植入术史、心绞痛史,应激试验、心肌闪烁显像或冠状动脉造影结果阳性)、心力衰竭(依据既往病史、临床诊断或超声心动图确诊)、甲状腺功能异常(亚临床甲状腺功能异常或明显甲状腺功能减退或甲亢)、缺血性脑卒中(符合缺血性脑卒中诊断标准[9]); 正在服用的药物包括β受体阻滞剂、非二氢吡啶类钙离子拮抗剂、强心药(地高辛)、抗凝药物(华法林、达比加群、利伐沙班)。
1.3 动态心电图监测
使用美国DELMAR公司LifecardCF 24 h动态心电图监测仪,连续监测24 h心电变化。HRV时域指标包括正常RR间期标准差(SDNN)、全程每5 min RR间期平均值的标准差(SDANN)、相邻NN间期差值的均方根(RMSSD)、全程记录中5 min NN间期标准差平均值(SDNN index)、心率变异指数(HRV index)和相邻NN间期差值>50 ms的心搏数占NN间期总搏数的百分比(PNN50)[10]。
1.4 统计学分析
采用SPSS 22.0统计学软件分析数据,符合正态分布的计量资料以(x±s)描述,组间比较采用t检验,非正态分布的计量资料以[M(P25, P75)]表示,组间比较采用秩和检验,计数资料以[n(%)]描述。采用多元线性回归分析探讨HRV时域指标(因变量)与心率、基础临床特征(自变量)的相关性。P < 0.05为差异有统计学意义。
2. 结果
2.1 2组心率、HRV时域指标比较
房颤组的24 h平均心率、SDNN、RMSSD、HRV index、PNN50、SDNN index均高于对照组,差异有统计学意义(P < 0.01); 房颤组SDANN与对照组比较,差异无统计学意义(P>0.05)。见表 1。
表 1 2组心率和HRV时域指标比较(x±s)[M(P25, P75)]组别 n 心率/min-1 SDNN/ms RMSSD/ms HRV index PNN50/% SDNN index/ms SDANN/ms 房颤组 108 75.3±18.4** 189.0(145.2, 237.3)** 233.8(177.3, 280.3)** 22.8(16.8, 29.8)** 76.6(68.9, 81.0)** 164.9(124.6, 205.4)** 77.4(58.0, 113.7) 对照组 127 67.7±9.5 98.0(76.4, 126.9) 39.9(29.5, 63.7) 13.2(10.1, 16.3) 5.6(3.0, 17.6) 30.8(23.1, 41.0) 87.4(67.4, 109.1) HRV: 心率变异性; SDNN: 正常RR间期标准差; RMSSD: 相邻NN间期差值的均方根; HRV index: 心率变异指数; PNN50: 相邻NN间期差值>50 ms的心搏数占NN间期总搏数的百分比; SDNN index: 全程记录中5 min NN间期标准差平均值; SDANN: 全程每5 min RR间期平均值的标准差。与对照组比较, * * P < 0.01。 2.2 房颤组患者基础临床特征
房颤组108例患者中,男74例,女34例; 年龄80~97岁,平均(88.3±4.1)岁; 共病包括高血压83例、糖尿病32例、冠心病66例、心力衰竭43例、甲状腺功能异常5例、缺血性脑卒中12例; 正在服用的药物包括β受体阻滞剂47例、非二氢吡啶类钙离子拮抗剂6例、地高辛29例、华法林15例、达比加群18例、利伐沙班20例。
2.3 房颤组HRV时域指标与患者基础临床特征的关系
多元线性回归分析结果显示, SDNN升高与高血压(P=0.001)、服用β受体阻滞剂(P=0.003)、心率慢(P < 0.001)显著相关,见表 2; RMSSD升高与高血压(P=0.040)、服用β受体阻滞剂(P=0.002)、心率慢(P < 0.001)显著相关,见表 3; HRV index升高与心力衰竭(P=0.003)、心率慢(P < 0.001)显著相关,见表 4; PNN50升高与心率慢(P=0.004)显著相关,见表 5; SDNN index升高与服用β受体阻滞剂(P=0.002)、心率慢(P < 0.001)显著相关,见表 6; SDANN升高与高血压(P=0.006)、心率慢(P < 0.001)、服用达比加群(P=0.021)显著相关,见表 7。
表 2 SDNN与基础临床特征的多元线性回归分析自变量 非标准化系数 SE t P 年龄 0.385 0.945 0.407 0.685 性别 3.711 9.079 0.409 0.684 高血压 33.391 9.285 3.596 0.001 糖尿病 -0.545 8.695 -0.063 0.950 冠心病 -12.571 8.109 -1.550 0.125 心力衰竭 -12.525 8.459 -1.481 0.142 甲状腺功能异常 0.507 18.358 0.028 0.978 缺血性脑卒中 -2.497 14.080 -0.177 0.860 β受体阻滞剂 24.385 7.962 3.063 0.003 非二氢吡啶类钙离子拮抗剂 -0.637 16.343 -0.039 0.969 地高辛 9.246 9.391 0.985 0.327 华法林 1.132 11.580 0.098 0.922 达比加群 27.925 10.879 2.567 0.012 利伐沙班 0.997 11.032 0.090 0.928 心率 -2.027 0.217 -9.337 < 0.001 表 3 RMSSD与基础临床特征的多元线性回归分析自变量 非标准化系数 SE t P 年龄 0.683 1.460 0.468 0.641 性别 6.620 14.032 0.472 0.638 高血压 29.868 14.351 2.081 0.040 糖尿病 -4.764 13.439 -0.354 0.724 冠心病 -7.124 12.534 -0.568 0.571 心力衰竭 -12.055 13.075 -0.922 0.359 甲状腺功能异常 -5.215 28.375 -0.184 0.855 缺血性脑卒中 2.090 21.762 0.096 0.924 β受体阻滞剂 39.973 12.306 3.248 0.002 非二氢吡啶类钙离子拮抗剂 2.712 25.260 0.107 0.915 地高辛 7.913 14.515 0.545 0.587 华法林 3.047 17.899 0.170 0.865 达比加群 8.227 16.815 0.489 0.626 利伐沙班 10.107 17.052 0.593 0.555 心率 -1.631 0.336 -4.862 < 0.001 表 4 HRV index与基础临床特征的多元线性回归分析自变量 非标准化系数 SE t P 年龄 0.026 0.178 0.148 0.883 性别 0.482 1.714 0.281 0.779 高血压 -0.660 1.753 -0.376 0.707 糖尿病 -1.241 1.641 -0.756 0.452 冠心病 0.561 1.531 0.367 0.715 心力衰竭 -4.838 1.597 -3.030 0.003 甲状腺功能异常 3.019 3.465 0.871 0.386 缺血性脑卒中 5.125 2.658 1.928 0.057 β受体阻滞剂 1.415 1.503 0.942 0.349 非二氢吡啶类钙离子拮抗剂 5.145 3.085 1.668 0.099 地高辛 1.937 1.773 1.093 0.277 华法林 2.033 2.186 0.930 0.355 达比加群 -1.485 2.054 -0.723 0.471 利伐沙班 0.649 2.083 0.312 0.756 心率 -0.307 0.041 -7.503 < 0.001 表 5 PNN50与基础临床特征的多元线性回归分析自变量 非标准化系数 SE t P 年龄 0.161 0.293 0.551 0.583 性别 3.034 2.813 1.079 0.284 高血压 -2.247 2.877 -0.781 0.437 糖尿病 -0.576 2.694 -0.214 0.831 冠心病 1.868 2.512 0.743 0.459 心力衰竭 -1.237 2.621 -0.472 0.638 甲状腺功能异常 3.933 5.687 0.692 0.491 缺血性脑卒中 2.215 4.362 0.508 0.613 β受体阻滞剂 3.440 2.467 1.395 0.166 非二氢吡啶类钙离子拮抗剂 3.792 5.063 0.749 0.456 地高辛 0.506 2.909 0.174 0.862 华法林 4.304 3.588 1.200 0.233 达比加群 -2.462 3.370 -0.730 0.467 利伐沙班 4.895 3.418 1.432 0.155 心率 -0.198 0.067 -2.938 0.004 表 6 SDNN index与基础临床特征的多元线性回归分析自变量 非标准化系数 SE t P 年龄 0.311 1.038 0.299 0.765 性别 3.736 9.975 0.374 0.709 高血压 18.350 10.201 1.799 0.075 糖尿病 -3.667 9.553 -0.384 0.702 冠心病 -3.499 8.910 -0.393 0.695 心力衰竭 -7.105 9.294 -0.764 0.447 甲状腺功能异常 -1.577 20.170 0.078 0.938 缺血性脑卒中 0.705 15.469 0.046 0.964 β受体阻滞剂 27.533 8.748 3.147 0.002 非二氢吡啶类钙离子拮抗剂 9.256 17.956 0.515 0.607 地高辛 4.734 10.318 0.459 0.647 华法林 8.135 12.723 0.639 0.524 达比加群 9.167 11.953 0.767 0.445 利伐沙班 14.680 12.121 1.211 0.229 心率 -1.324 0.239 -5.552 < 0.001 表 7 SDANN与基础临床特征的多元线性回归分析自变量 非标准化系数 SE t P 年龄 0.433 0.913 0.474 0.637 性别 2.442 8.771 0.278 0.781 高血压 25.155 8.970 2.804 0.006 糖尿病 -0.455 8.400 -0.054 0.957 冠心病 -10.919 7.834 -1.394 0.167 心力衰竭 -15.479 8.172 -1.894 0.061 甲状腺功能异常 1.386 17.735 0.078 0.938 缺血性脑卒中 1.263 13.602 0.093 0.926 β受体阻滞剂 2.430 7.692 0.316 0.753 非二氢吡啶类钙离子拮抗剂 -2.403 15.788 -0.152 0.879 地高辛 5.745 9.072 0.633 0.528 华法林 -3.418 11.188 -0.305 0.761 达比加群 24.656 10.510 2.346 0.021 利伐沙班 -17.219 10.658 -1.616 0.110 心率 -1.427 0.210 -6.804 < 0.001 3. 讨论
HRV是评估交感与副交感神经活性的主要指标之一,可定量描述心脏交感神经与迷走神经的张力及平衡性。本研究结果显示,超高龄房颤患者的HRV时域指标SDNN、RMSSD、HRV index、PNN50、SDNN index均显著高于对照者,提示迷走神经张力呈病理性增高。迷走神经张力增高可引起窦房结兴奋性降低、房室结传导减慢和心房有效不应期显著缩短,进而促进房颤发生并增加房颤稳定性[11-12]。进一步行多元线性回归分析发现,房颤患者的HRV时域指标与部分基础临床特征存在相关性,其中心率与所有HRV时域指标呈显著负相关。心率与HRV的负相关性已在房颤患者[3]和窦性心律患者[13]中得到证实,因为心动过速和HRV降低均继发于交感神经性活性增强和迷走神经活性降低。
本研究结果显示,β受体阻滞剂治疗与HRV时域指标SDNN、RMSSD、SDNN index的升高显著相关。无论心率是否降低, β受体阻滞剂均会影响自主神经系统,其对超高龄房颤患者HRV的影响可能有助于降低恶性心律失常及猝死风险。本研究还发现,临床用于控制心室率的地高辛、非二氢吡啶类钙离子拮抗剂与超高龄房颤患者HRV时域指标均无显著相关性,提示其无法调节自主神经功能。然而BUTTC等[1]研究指出,洋地黄、非二氢吡啶类钙离子拮抗剂治疗均与房颤患者较高的HRV相关。造成该差异的原因可能与患者年龄不同有关,本研究纳入患者均为超高龄患者,此类人群HRV显著下降、自主神经功能受损,心源性猝死风险增加[14-15]。
本研究发现,服用达比加群与SDANN升高显著相关,但与反映迷走神经活动的PNN50、RMSSD无关。这可能是因为达比加群对神经功能的影响主要体现在交感神经系统,但本研究仅18例患者服用达比加群,样本量较少,未来还需增加样本量开展临床试验加以验证。本研究结果显示,高血压与较高的SDNN、RMSSD、SDANN均显著相关,提示高血压能影响超高龄房颤患者的自主神经功能,且可能具有保护效应。这与既往研究[14, 16]提出的高血压患者各HRV时域指标均低于健康人群且缺乏昼夜节律的结论存在差异。造成该差异的可能原因包括: 既往研究纳入的研究对象为窦性心律患者,本研究则为房颤患者; 本研究纳入患者均为超高龄患者,平均年龄高达(88.31±4.05)岁,与既往研究[16]中的患者年龄存在显著差异。超高龄老人普遍存在HRV显著降低现象,其机制可能与迷走神经功能衰退有关。
综上所述,超高龄持续性房颤患者的HRV与基础临床特征存在相关性。但本研究为回顾性研究,且样本量较少,有待后续增加样本量开展前瞻性研究加以验证。
-
表 1 2007—2018年20~65岁女性不同睡眠时间比较[n(%)](x±s)
基线资料 分类 全组(n=9 353) 睡眠不足(n=3 189) 非睡眠不足(n=6 164) t/χ2 P 年龄 20~44岁 4 989(53.3) 1 627(51.0) 3 362(54.5) 10.34 0.001 45~65岁 4 364(46.7) 1 562(49.0) 2 802(45.5) 种族 墨西哥美人 1 480 (15.8) 448(14.1) 1 032(16.7) 157.51 <0.001 其他西班牙裔 1 004(10.7) 366(11.5) 638(10.4) 非西班牙裔白人 3 660(39.1) 1 108(34.7) 2 552(41.4) 非西班牙裔黑人 2 045(21.9) 923(28.9) 1 122(18.2) 其他人种 1 164(12.4) 344(10.8) 820(13.3) 受教育程度 高中以下 1 779(19.0) 649(20.4) 1 130(18.3) 8.04 0.018 高中 1 952(20.9) 683(21.4) 1 269(20.6) 高中以上 5 622(60.1) 1 857(58.2) 3 765(61.1) 婚姻状况 已婚 4 515(48.3) 1 375(43.1) 3 140(50.9) 90.81 <0.001 寡居 343(3.7) 145(4.5) 198(3.2) 离婚 1 220(13.0) 501(15.7) 719(11.7) 未婚 392(4.2) 182(5.7) 210(3.4) 与伴侣同住 2 012(21.5) 700(22.0) 1312(21.3) 与伴侣不同住 871(9.3) 286(9.0) 585(9.5) 采集月份 当年11月—次年4月 4 518(48.3) 1 514(47.5) 3 004(48.7) 1.28 0.257 同年5—10月 4 835(51.7) 1 675(52.5) 3 160(51.3) 高血压 2 587(27.7) 1 020(32.0) 1 567(25.4) 44.98 <0.001 糖尿病 845(9.0) 340(10.7) 505(8.2) 19.29 <0.001 抑郁 1 088(11.6) 540(16.9) 548(8.9) 131.48 <0.001 PHQ-9评分/分 3.8±4.6 4.8±5.2 3.3±4.2 15.70 <0.001 体质量指数/(kg/m2) 29.9±8.0 30.8±8.3 29.5±7.8 7.484 <0.001 收入与贫困基线比值 2.5±1.7 2.3±1.6 2.6±1.7 6.88 <0.001 表 2 20~65岁不同睡眠时间女性的血清维生素D代谢物比较[M(P25,P75)]
nmol/L 项目 检出 全组(n=9 353) 睡眠不足(n=3 189) 非睡眠不足(n=6 164) Z P 25(OH)D3 9 353(100.0) 56.5(38.3, 75.6) 51.9(35.4, 70.4) 59.0(40.3, 77.7) -3.12 <0.001 25(OH)D2 1 967(21.0) 1.5(1.5, 1.5) 1.45(1.5, 1.5) 1.45(1.5, 1.5) - - 25(OH)D 9 353(100.0) 60.4(42.4, 79.2) 56.2(39.2, 75.0) 62.5(44.2, 80.9) -10.06 <0.001 表 3 睡眠不足女性血清维生素D代谢物浓度的Logistic回归模型结果
回归模型 血清维生素D代谢物 β S.E OR 95%CI P 模型1 25(OH)D3 0.008 0.001 1.008 1 1.006 5~1.009 7 <0.001 25(OH)D 0.008 0.001 1.007 8 1.006 2~1.009 4 <0.001 模型2 25(OH)D3 0.005 0.001 1.005 5 1.003 6~1.007 3 <0.001 25(OH)D 0.006 0.001 1.005 7 1.003 9~1.007 6 <0.001 模型1: 未调整变量; 模型2:调整年龄、种族、婚姻状况、教育程度、收入与贫困基线比值、BMI、采集月份、高血压、糖尿病、PHQ-9评分后的模型。 -
[1] PANEL C C, WATSON N F, BADR M S, et al. Joint consensus statement of the American academy of sleep medicine and sleep research society on the recommended amount of sleep for a healthy adult: methodology and discussion[J]. J Clin Sleep Med, 2015, 11(8): 931-952. doi: 10.5664/jcsm.4950
[2] FORD E S, CUNNINGHAM T J, CROFT J B. Trends in self-reported sleep duration among US adults from 1985 to 2012[J]. Sleep, 2015, 38(5): 829-832. doi: 10.5665/sleep.4684
[3] 国务院关于实施健康中国行动的意见[EB/OL]. (2018-06-27)[2020-03-06]. http://www.gov.cn/xinwen/2021-07/15/content_5409694.htm. [4] 袁帆, 丁彩翠, 宫伟彦, 等. 我国职业人群睡眠状况及其影响因素分析[J]. 中国公共卫生, 2018, 34(6): 791-794. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGGW201806003.htm [5] PENGO M F, WON C H, BOURJEILY G. Sleep in women across the life span[J]. Chest, 2018, 154(1): 196-206. doi: 10.1016/j.chest.2018.04.005
[6] TAMANNA S, GERACI S A. Major sleep disorders among women: (women's health series)[J]. South Med J, 2013, 106(8): 470-478. doi: 10.1097/SMJ.0b013e3182a15af5
[7] ZERWEKH J E. Blood biomarkers of vitamin D status[J]. Am J Clin Nutr, 2008, 87(4): 1087S-1091S. doi: 10.1093/ajcn/87.4.1087S
[8] 李健, 白文佩, 江波, 等. 生酮饮食对超重/肥胖多囊卵巢综合征患者维生素D及糖脂代谢的影响[J]. 实用临床医药杂志, 2022, 26(4): 14-17, 32. doi: 10.7619/jcmp.20220496 [9] GONG Q H, LI S X, LI H, et al. 25-Hydroxyvitamin D Status and Its Association with Sleep Duration in Chinese Schoolchildren[J]. Nutrients, 2018, 10(8): 1013. doi: 10.3390/nu10081013
[10] KIM J H, CHANG J H, KIM D Y, et al. Association between self-reported sleep duration and serum vitamin D level in elderly Korean adults[J]. J Am Geriatr Soc, 2014, 62(12): 2327-2332. doi: 10.1111/jgs.13148
[11] PATEL J S, OH Y, RAND K L, et al. Measurement invariance of the patient health questionnaire-9(PHQ-9) depression screener in U. S. adults across sex, race/ethnicity, and education level: NHANES 2005-2016[J]. Depress Anxiety, 2019, 36(9): 813-823. doi: 10.1002/da.22940
[12] MANEA L, GILBODY S, MCMILLAN D. Optimal cut-off score for diagnosing depression with the Patient Health Questionnaire (PHQ-9): a meta-analysis[J]. CMAJ, 2012, 184(3): E191-E196. doi: 10.1503/cmaj.110829
[13] HIRSHKOWITZ M, WHITON K, ALBERT S M, et al. National Sleep Foundation's sleep time duration recommendations: methodology and results summary[J]. Sleep Heal, 2015, 1(1): 40-43. doi: 10.1016/j.sleh.2014.12.010
[14] STUMPF W E, SAR M, CLARK S A, et al. Brain target sites for 1, 25-dihydroxyvitamin D3[J]. Science, 1982, 215(4538): 1403-1405. doi: 10.1126/science.6977846
[15] MUSIOL I M, STUMPF W E, BIDMON H J, et al. Vitamin D nuclear binding to neurons of the septal, substriatal and amygdaloid area in the Siberian hamster (Phodopus sungorus) brain[J]. Neuroscience, 1992, 48(4): 841-848. doi: 10.1016/0306-4522(92)90272-4
[16] DE OLIVEIRA D L, HIROTSU C, TUFIK S, et al. The interfaces between vitamin D, sleep and pain[J]. J Endocrinol, 2017, 234(1): R23-R36. doi: 10.1530/JOE-16-0514
[17] MUSCOGIURI G, BARREA L, SCANNAPIECO M, et al. The lullaby of the sun: the role of vitamin D in sleep disturbance[J]. Sleep Med, 2019, 54: 262-265. doi: 10.1016/j.sleep.2018.10.033
[18] HOLICK M F, BINKLEY N C, BISCHOFF-FERRARI H A, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an endocrine society clinical practice guideline[J]. J Clin Endocrinol Metab, 2011, 96(7): 1911-1930. doi: 10.1210/jc.2011-0385
[19] WILSON L R, TRIPKOVIC L, HART K H, et al. Vitamin D deficiency as a public health issue: using vitamin D2 or vitamin D3 in future fortification strategies[J]. Proc Nutr Soc, 2017, 76(3): 392-399. doi: 10.1017/S0029665117000349
[20] GUTIERREZ-MONREAL M A, CUEVAS-DIAZ DURAN R, MORENO-CUEVAS J E, et al. A role for 1α, 25-dihydroxyvitamin d3 in the expression of circadian genes[J]. J Biol Rhythms, 2014, 29(5): 384-388. doi: 10.1177/0748730414549239
[21] HÉNIQUE C, MANSOURI A, VAVROVA E, et al. Increasing mitochondrial muscle fatty acid oxidation induces skeletal muscle remodeling toward an oxidative phenotype[J]. FASEB J, 2015, 29(6): 2473-2483. doi: 10.1096/fj.14-257717
[22] SRINIVASAN V, PANDI-PERUMAL S R, TRAHKT I, et al. Melatonin and melatonergic drugs on sleep: possible mechanisms of action[J]. Int J Neurosci, 2009, 119(6): 821-846. doi: 10.1080/00207450802328607
[23] IKONTE C J, MUN J G, REIDER C A, et al. Micronutrient Inadequacy in Short Sleep: Analysis of the NHANES 2005-2016[J]. Nutrients, 2019, 11(10). 2335. doi: 10.3390/nu11102335
[24] GOMINAK S C, STUMPF W E. The world epidemic of sleep disorders is linked to vitamin D deficiency[J]. Med Hypotheses, 2012, 79(2): 132-135. doi: 10.1016/j.mehy.2012.03.031
[25] KILEY J P, TWERY M J, GIBBONS G H. The national center on sleep disorders research-progress and promise[J]. Sleep, 2019, 42(6): zsz105. doi: 10.1093/sleep/zsz105
[26] HAFNER M, STEPANEK M, TAYLOR J, et al. Why sleep matters-the economic costs of insufficient sleep: a cross-country comparative analysis[J]. Rand Heal Q, 2017, 6(4): 11.
[27] KHUBCHANDANI J, PRICE J H. Short sleep duration in working American adults, 2010-2018[J]. J Community Heal, 2020, 45(2): 219-227. doi: 10.1007/s10900-019-00731-9
[28] LI R X, MA M, XIAO X R, et al. Perimenopausal syndrome and mood disorders in perimenopause: prevalence, severity, relationships, and risk factors[J]. Medicine, 2016, 95(32): e4466. doi: 10.1097/MD.0000000000004466
[29] KLINEDINST B S, MEIER N F, LARSEN B, et al. Walking in the light: how history of physical activity, sunlight, and vitamin D account for body fat-A UK biobank study[J]. Obes Silver Spring Md, 2020, 28(8): 1428-1437. doi: 10.1002/oby.22852
[30] HUIBERTS L M, SMOLDERS K. Effects of vitamin D on mood and sleep in the healthy population: Interpretations from the serotonergic pathway[J]. Sleep Med Rev, 2021, 55: 101379. doi: 10.1016/j.smrv.2020.101379
-
期刊类型引用(1)
1. 黄海芬,陈清勇,何芳,李韧. 高血压伴冠心病患者无创心输出量测量下个体化方案治疗的效果及机制. 实用临床医药杂志. 2025(05): 70-75+81 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号