Epithelial expression of stromal interaction molecule 1/calcium release-activated calcium channel protein 1 in asthmatic airway hyperresponsiveness and its role
-
摘要:目的
探讨基质相互作用分子1(STIM1)/钙通道蛋白1(Orail)在哮喘气道高反应性(AHR)中的上皮表达和作用。
方法将小鼠分为对照组、鸡卵清蛋白(OVA)组和OVA+sh-STIM1组,每组12只。除对照组外,其余组建立OVA诱导的小鼠急性哮喘模型。OVA+sh-STIM1组通过鼻内给予sh-STIM1进行干预。通过免疫荧光染色检查肺组织中STIM1表达。采用酶联免疫吸附试验(ELISA)检测小鼠支气管肺泡灌洗液(BALF)中炎症因子水平。分析在人气道平滑肌细胞(HASMC)中,STIM1敲低对气道平滑肌(ASM)细胞的收缩力和钙离子(Ca2+)流入的影响。
结果STIM1主要在支气管上皮中表达,鼻内给予sh-STIM1可减轻小鼠的AHR和炎症。体外实验中,STIM1敲低通过阻断Oria1介导钙库操纵的钙内流来抑制HASMC细胞收缩。
结论上皮细胞中STIM1调节气道平滑肌收缩和AHR,其作用机制与激活Oria1介导的钙内流有关。
Abstract:ObjectiveTo investigate the epithelial expression of stromal interaction molecule 1 (STIM1)/calcium release-activated calcium channel protein 1(Orail)in airway hyperresponsiveness (AHR) and its role.
MethodsThe mice were divided into control group, ovalbumin (OVA) group and OVA+sh-STIM1 group, with 12 mice in each group. Except for the control group, the other groups established OVA-induced acute asthma mice models. The OVA+sh-STIM1 group was given sh-STIM1 intranasally for intervention. The expression of STIM1 in lung tissue was checked by immunofluorescence staining. Enzyme-linked immunosorbent assay (ELISA) was used to detect the level of inflammatory factors in mouse bronchoalveolar lavage fluid (BALF). The effects of STIM1 knockdown on contractility and Ca2+ influx of airway smooth muscle (ASM) cells in human airway smooth muscle cells (HASMC) were analyzed.
ResultsSTIM1 was mainly expressed in bronchial epithelium, and intranasal administration of sh-STIM1 could relieve AHR and inflammation in mice. In vitro, STIM1 knockdown inhibited the contraction of HASMC cells by blocking Oria1 mediated calcium influx ex vivo.
ConclusionSTIM1 in epithelial cells regulates airway smooth muscle contraction and AHR, and its mechanism of action is related to the activation of Oria1-mediated calcium influx.
-
哮喘是全球最常见的慢性病之一 [1]。气道高反应性(AHR)是过敏性哮喘的主要特征[2]。AHR与气道平滑肌(ASM)收缩有关,并受胞质钙离子(Ca2+)水平调节,突出了Ca2+稳态在哮喘中的重要性[2]。全基因组分析确定了12个与哮喘相关的表观遗传相互作用基因,包括基质相互作用分子1(STIM1)[3]。STIM1是一种钙调节激素,广泛分布于肾脏、子宫内膜和肺等组织中,可以通过激活钙通道蛋白1(Oria1)介导钙库操纵的钙内流(SOCE)[4]。因此,本研究假设STIM1可能是与哮喘AHR相关的重要上皮衍生因子,其通过介导Ca2+流入来调节ASM收缩。验证这一假设,本研究拟通过建立哮喘小鼠模型,探讨STIM1/Orail信号通路介导的SOCE在AHR中的作用。
1. 材料与方法
1.1 实验动物
36只雌性Balb/c小鼠[8~10周龄, (20.0±1.1) g]购自北京维通利华实验动物技术有限公司。小鼠在标准条件[温度为(22±1) ℃; 湿度为55%~60%; 12 h明暗循环)]下饲养,可自由获取水和食物。适应1周后,将小鼠随机分为3组(每组12只),即对照组(CON)、鸡卵清蛋白(OVA)组和OVA+sh-STIM1组(OVA来源于鸡蛋,是一种常用的过敏原,可在实验室啮齿动物中诱发过敏性肺部炎症。)。参照文献[5]中方法建立OVA诱导的小鼠急性哮喘模型。除对照组外,其他组分别在第0、7、14天通过腹腔注射50 μg OVA(纯度≥98%, 美国Sigma-Aldrich公司)致敏。小鼠用异氟醚麻醉,连续3 d(第21、22、23天)通过吸入溶解在100 μL生理盐水中的150 μg OVA进行致敏。对照组采用等量生理盐水处理。OVA+sh-STIM1组小鼠在第21、22、23天用OVA致敏前8 h, 通过鼻内给予100 μL慢病毒介导的STIM1小干扰RNA[sh-STIM1, 汉恒生物科技(上海)有限公司]。
1.2 慢病毒介导的短发夹载体的构建与感染
对于短发夹RNA (shRNA) 介导的STIM1敲低,用从上海GeneChem Corporation公司购买的STIM1-pGCSIL-GFP质粒产生的慢病毒颗粒转染细胞。shRNA的靶向序列为[6]: 5′-GGAGGATAATGGCTCTATT-3′。阴性对照是与任何已知人类基因没有序列同源性的双链shRNA。对于基因沉默,将纯化的慢病毒(sh-STIM1-1)以20的感染复数添加到细胞中,持续8 h, 并用培养基洗涤2次。通过GFP表达监测发现感染复数为20时, 72 h后癌细胞感染率超过90%。因此,本研究在所有实验中对慢病毒使用了20的感染复数,因为其在所需的时间内产生了最佳的基因敲低。对照细胞用阴性对照shRNA感染。
1.3 气道高反应性的测量
在实验第24天,通过全身气压体积描记在8~10周龄的小鼠(每组6只小鼠)中评估对乙酰甲胆碱(Mch, 美国Sigma-Aldrich公司)的气道反应性。小鼠用戊巴比妥(100 mg/kg)腹腔注射麻醉,并暴露于含Mch(0、3.125、6.250、12.500、25.000和50.000 mg/mL)的磷酸盐缓冲液(PBS)雾化中,利用全身瀑体积测量法(型号PLY 3211, 美国Buxco Electronic公司)记录增强的停顿(Penh)。
1.4 苏木精和曙红染色及炎症评分
在实验第24天,处死小鼠,取右上叶石蜡包埋,矢状切片(5 μm厚),苏木精-伊红(HE)染色。将炎症浸润程度定为: 0分,无炎症细胞; 1分,炎症细胞少; 2分,炎症细胞呈圆形,厚度为1个细胞; 3分,炎症细胞呈圆形,厚度为2~4个细胞; 4分,炎症细胞形成圆形,厚度>4个细胞。由对样本不知情的研究人员在每张载玻片上随机选择的6个区域中对炎症进行评分。总炎症评分计算为所有个体炎症评分的平均值。
1.5 免疫荧光染色
肺组织切片(5 μm) 进行抗原修复,并在室温下浸入山羊血清15 min, 以避免非特异性结合。然后将切片与1∶ 50稀释的抗STIM1 (美国Santa cruz公司) 一抗在4 ℃下孵育过夜。PBS洗涤3次后,将切片与1∶ 200稀释的Cy3标记的山羊抗兔IgG抗体(上海Beyotime公司)在室温下一起孵育90 min。最后,切片用二脒基苯基吲哚(DAPI)染色并用PBS洗涤3次。在放大倍数为400倍的荧光显微镜下观察切片。
1.6 免疫组织化学
通过免疫组织化学染色检测α-平滑肌肌动蛋白(α-SMA)在肺组织中的表达。用于免疫染色的主要抗体如下: 兔抗α-SMA多克隆抗体(1∶ 100, 英国Abcam公司)。二级抗体为HRP标记的抗兔抗体(美国Jackson ImmunoResearch公司)。
1.7 酶联免疫吸附试验(ELISA)
所有组均进行气管分离,行气管插管,用0.5 mL PBS灌洗小鼠支气管肺泡,收集支气管肺泡灌洗液(BALF), 共3次,每次回收率达82%。根据ELISA试剂盒说明(美国R&D公司),检测小鼠BALF中白细胞介素(IL)-4、IL-5、单核细胞趋化蛋白(MCP-1)和IL-13水平。
1.8 细胞培养
人气道平滑肌细胞(HASMC,美国Sciencell公司)接种在SMCM培养基(Sciencell)中,并在37 ℃、5%CO2的湿润环境中培养。HASMC连续传代并取第4代用于实验。将HASMC以1×104个细胞/cm2的密度接种在细胞培养板中。细胞实验分为4组: 对照组(CON)、ACh组、ACh+sh-STIM1组和sh-STIM1组。ACh+sh-STIM1组和sh-STIM1组细胞在乙酰胆碱(ACh)干预前用sh-STIM1-1感染细胞8 h,以敲低细胞中STIM1表达。
1.9 细胞收缩试验
将HASMC重新悬浮在使用冷胶原蛋白Ⅰ型(纯度=90%, 溶于0.02 mol/L乙酸的液体, 1.5 mg/mL, 美国BD Biosciences公司)制备的胶原蛋白溶液中,该胶原蛋白溶液每孔含有1.5×105个细胞。将凝胶加入24孔板(600 μL/孔) 并在37 ℃下聚合90 min。将ACh(美国Sigma-Aldrich公司)添加到适当的孔中至终浓度为100 μmol/L, 并在4 h时拍摄照片。处理后立即使用灭菌探针从孔边缘提起凝胶。使用NIH Image J在每个时间点测量每个凝胶的表面积。
1.10 钙成像
通过Fura-2AM(钙离子荧光探针,上海Beyotime公司)测量HASMC中的钙成像。将24孔板(2.5×103个细胞/孔)中的HASMC与250 μL含有2.5 μL/mL Fura-2AM的标准林格氏溶液(pH值为7.4)孵育30 min。然后用HBSS洗涤细胞3次。将HBSS中的ACh(100 μmol/L)或thapsigargin抑制剂(TG, 2 μmol/L)添加到相关孔中,并在37 ℃下孵育2 h。去除上清液以拍摄图像。使用珀耳帖冷却电荷耦合器件(CCD)相机(美国Roper Scientific公司)在荧光显微镜(10倍物镜)下检测细胞中的Fura-2AM荧光。使用荧光滤光片组在495 nm和518 nm处交替获得Fura-2AM荧光。信号转换为相对变化(F/F0), 其中F0是时间0的平均荧光强度(495/518)的比率。每孔记录15个细胞。
1.11 蛋白质印迹
使用SDS裂解缓冲液收获细胞。不同处理组中等量的蛋白质进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)并转移到硝酸纤维素膜(美国Millipore公司)。膜在3%牛血清白蛋白(BSA)中封闭,随后与兔多克隆Oria1抗体(1∶ 1 000, 美国Cell Signaling Technology公司)、兔单克隆抗体GAPDH(1∶ 1 000, 美国Cell Signaling Technology公司)在4 ℃下孵育过夜。HRP偶联的单克隆山羊抗兔IgG(1∶ 5 000, 上海Bioworld公司)抗体用作二抗。使用ECL试剂(美国Millipore公司)显示条带。使用NIH Image Pro对光密度扫描进行量化,并将值表示为与GAPDH相比的相对强度。
1.12 实时定量聚合酶链反应(PCR)
使用Trizol试剂(美国Invitrogen公司)分离总RNA。然后使用PrimeScriptTM逆转录酶(日本Takara公司)将1 μg总RNA逆转录cDNA, 并使用TaqMan Gene Expression Assay试剂盒在ABI Prism 7000(美国Applied Biosystems公司)上进行定量实时PCR分析。PCR中使用的引物如下, STIM1 : 5′-AGTCACAGTGAGAAGGCGAC-3′(正向), 5′-CAATTCGGCAAAACTCTGCTG-3′(反向); Orai1 : 5′-GACTGGATCGGCCAGAGTTAC-3′(正向), 5′-GTCCGGCTGGAGGCTTTAAG-3′(反向); GAPDH: 5′-GGAGCGAGATCCCTCCAAAAT-3′ (正向), 5′-GGCTGTTGTCATACTTCTCATGG-3′(反向)。循环条件是在95 ℃下初始变性30 s, 然后在95 ℃ 5 s、60 ℃ 30 s和72 ℃ 10 min进行40个循环。使用2-△△CT方法计算数据并归一化为GAPDH。
1.13 统计学分析
所有数据均以(x±s)表示。使用SPSS 22.0软件分析数据。使用单向方差分析检查2组以上的差异,然后在小鼠实验中采用Tukey事后分析以及细胞实验中采用Student-Newman-Keuls事后分析进行两两比较。P < 0.05为差异有统计学意义。
2. 结果
2.1 STIM1在鼠支气管上皮细胞中高表达
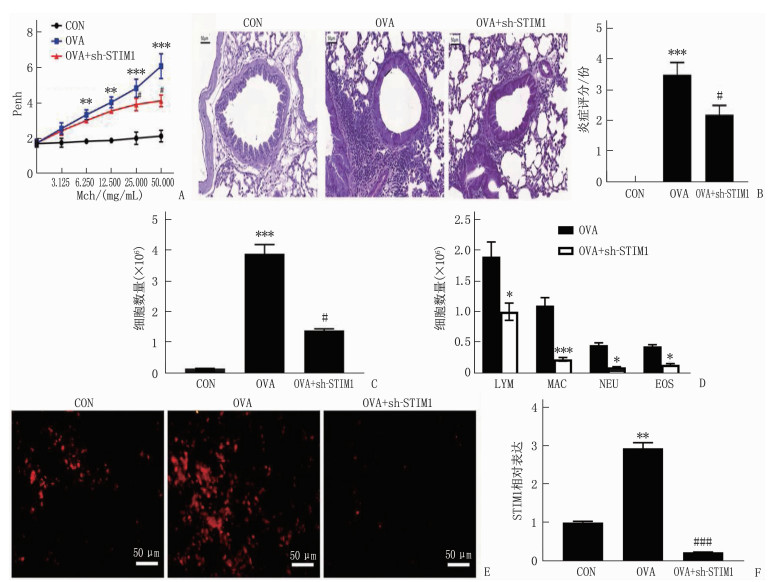
OVA组小鼠表现出气道阻力增加(图 1A)以及组织(图 1B)和BALF(图 1C、D)炎症。免疫荧光染色分析表明,与对照组相比,在OVA处理动物的支气管上皮细胞中STIM1表达增加(图 1E、F), 差异有统计学意义(P < 0.05)。这些结果表明STIM1在哮喘过敏模型中表达增加。
![]() 图 1 STIM1在鼠支气管上皮细胞中高表达A: 气道阻力的评估,各组通过flexiVent测量对乙酰甲胆碱(0~50 mg/mL)剂量增加的气道阻力,以记录增强暂停(n=6); B: 气道炎症的评估,苏木精-伊红染色观察支气管周围和肺泡区域的炎性细胞浸润; C: 各组之间的BALF中总白细胞计数; D: OVA组和OVA+sh-STIM1组BALF中白细胞的数量(NEU: 中性粒细胞; LYM: 淋巴细胞; MON: 单核细胞; EOS: 嗜酸性粒细胞); E、F: 各组支气管上皮细胞中STIM1表达的免疫荧光染色分析。与对照组相比, *P < 0.05, **P < 0.01, ***P < 0.001; 与OVA组相比, #P < 0.05, ###P < 0.001。
图 1 STIM1在鼠支气管上皮细胞中高表达A: 气道阻力的评估,各组通过flexiVent测量对乙酰甲胆碱(0~50 mg/mL)剂量增加的气道阻力,以记录增强暂停(n=6); B: 气道炎症的评估,苏木精-伊红染色观察支气管周围和肺泡区域的炎性细胞浸润; C: 各组之间的BALF中总白细胞计数; D: OVA组和OVA+sh-STIM1组BALF中白细胞的数量(NEU: 中性粒细胞; LYM: 淋巴细胞; MON: 单核细胞; EOS: 嗜酸性粒细胞); E、F: 各组支气管上皮细胞中STIM1表达的免疫荧光染色分析。与对照组相比, *P < 0.05, **P < 0.01, ***P < 0.001; 与OVA组相比, #P < 0.05, ###P < 0.001。2.2 STIM1敲低消除过敏性哮喘小鼠OVA诱导的AHR和ASM收缩
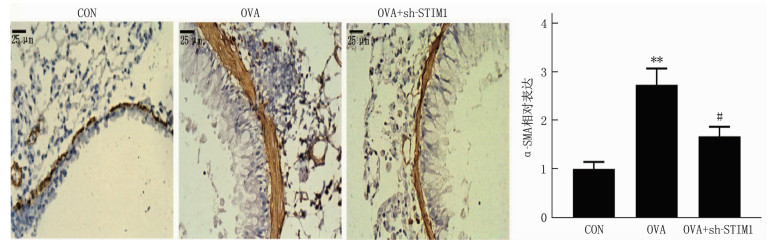
为了确定STIM1水平的降低是否与过敏性哮喘的病理学相关,本研究探讨了STIM1敲低对AHR的影响(图 1E、F)。与对照组相比, OVA组Mch激发后气道阻力增加,这被鼻内sh-STIM1逆转(图 1A、B)。免疫组织化学分析表明, OVA增强α-SMA表达(ASM激活的标志物)被鼻内sh-STIM1显著抑制(图 2)。这些结果表明STIM1在哮喘AHR中具有作用。
2.3 STIM1敲低抑制炎症细胞浸润及相关因子释放
OVA显著增强肺泡和支气管周围的炎性细胞浸润,鼻内sh-STIM1治疗显著减弱(图 1B)。BALF细胞计数表明, sh-STIM1给药显著抑制BALF中的细胞总数以及嗜酸性粒细胞、中性粒细胞和巨噬细胞的数量(图 1C、D)。OVA增强BALF表达Th2细胞因子释放,并且sh-STIM1治疗减弱OVA诱导的IL-13、IL-5和MCP-1释放,但对OVA诱导的IL-4释放无影响。见表 1。
表 1 STIM1敲低对BALF中炎症因子释放影响(n=6)(x±s)pg/mL 组别 IL-13 IL-4 IL-5 MCP-1 CON组 48.23±1.30 15.28±2.83 6.53±1.12 5.45±0.82 OVA组 137.65±15.42*** 27.62±3.25* 37.92±3.84** 38.72±4.67*** OVA+sh-STIM1组 71.49±8.74### 22.13±3.36 23.63±2.55# 14.91±2.51# IL: 白细胞介素; MCP-1: 单核细胞趋化蛋白。与对照组相比, * P < 0.05, * * P < 0.01, * * * P < 0.001; 与OVA组相比, #P < 0.05, ###P < 0.001。 2.4 STIM1敲低对ASM细胞的收缩力和Ca2+流入影响
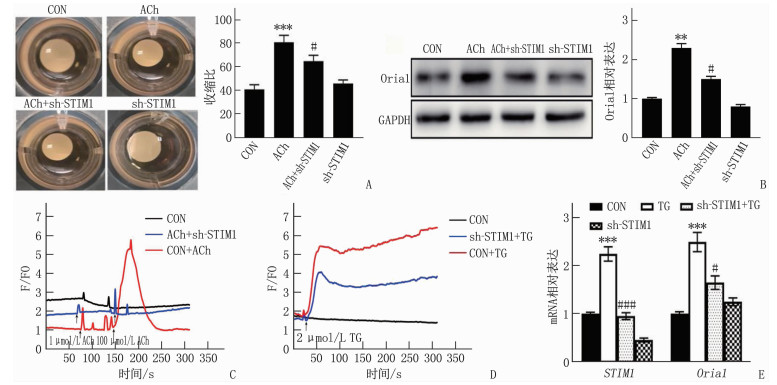
为了进一步探讨STIM1对ASM的影响,本研究在体外使用了HASMC。ACh(100 μmol/L) 诱导胶原基质中的HASMC在4 h后收缩约80%, 而对照组收缩约40%。sh-STIM1对HASMC的收缩没有影响[(41.31±3.27)%与(44.49±0.36)%]。然而,与sh-STIM1预处理显著抑制ACh诱导的收缩,表明ACh通过降低ASM收缩性来调节AHR(图 3A)。ASM收缩性由Oria1调节, ACh增加Oria1表达,通过sh-STIM1预处理完全减弱(图 3B)。ACh以浓度依赖性的方式增加了HASMC的SOCE, 这被sh-STIM1预处理完全消除(图 3C)。用非竞争性Ca2+ATP酶TG抑制剂(2.0 μmol/L)和1.2 mmol/L Ca2+处理HASMC可激活SOCE, 并进一步升高细胞质Ca2+水平,而sh-STIM1可降低这种效应(图 3D)。PCR结果显示, TG增强了 STIM1 mRNA和 Orai1 mRNA在HASMC中的表达,而sh-STIM1抑制了 STIM1 和 Orai1 表达(图 3E)。
3. 讨论
哮喘是一种复杂的疾病; AHR是哮喘表现的核心,与ASM收缩变化密切相关[7]。Ca2+信号对ASM细胞收缩、生长和迁移至关重要。SOCE通道是Ca2+进入ASM细胞的普遍方式之一[8]。STIM1是内质网中的Ca2+传感器,其在限定的内质网/质膜连接区域寡聚化,以激活Orai1形成SOCE通道[9]。STIM1/Orai1偶联的机制包括将STIM1的约100个氨基酸的C端卷曲螺旋区与Orai1四聚体的C端和N端直接结合[10]。哮喘中的ASM收缩变化与Ca2+处理异常以及离子通道及泵的表达变化有关[11]。本研究数据表明,气道上皮源性STIM1增加可能与ASM收缩和AHR有关,表明STIM1可能是一种潜在的内皮源性收缩因子。
上皮细胞是抵抗气道中有毒和过敏物质的第一道防线。除了物理屏障功能外,气道上皮还通过释放环氧合酶产物和内皮源性收缩因子在ASM张力的调节中发挥作用。本研究表明,STIM1主要定位于支气管上皮,对过敏性哮喘小鼠模型鼻内给予sh-STIM1可降低AHR。IL-13是一种Th2型细胞因子,与过敏性哮喘的发病有关[12]。IL-13除了对杯状细胞增生和增加黏液产生作用外,还可直接调节ASM的高收缩性,从而诱导哮喘患者的AHR[13]。此外, IL-13增加了HASMC对各种收缩剂(如组胺)的Ca2+反应[14]。这些结果强调了IL-13在过敏性哮喘AHR中的作用。本研究中, STIM1敲低可降低哮喘小鼠的AHR和炎症反应,表明STIM1对哮喘具有恶化作用, STIM1的过度活跃可能是对IL-13诱导的炎症应激反应的一种代偿机制。这一发现与既往研究[15-16]一致,表明STIM1是一种应激反应蛋白,参与诱导组织损伤,如急性肺损伤和心肌梗死。
ASM的超收缩性与哮喘的AHR密切相关[7]。一般ASM收缩是在气道炎症的背景下研究。然而,在使用胶原凝胶收缩试验对单个ASM细胞进行的研究中, ASM收缩不仅与气道炎症有关,还可能是由哮喘固有异常引起的,该异常在没有哮喘气道环境的原代培养中持续存在,表明哮喘ASM发生表观遗传或信号通路重塑[17]。ASM收缩是由增加的胞浆Ca2+水平引起的,随后开始形成Ca2+-钙调蛋白-肌球蛋白轻链激酶复合物,激活Oria1介导的SOCE。在此基础上,本研究探讨了STIM1对ASM收缩的作用。本研究结果显示,鼻内滴注sh-STIM1逆转了OVA诱导的过敏小鼠AHR。sh-STIM1通过抑制钙依赖性Oria1表达,进而抑制HASMC收缩性。由于SOCE对调节HASMC的Ca2+稳态至关重要,Oria1与STIM1的相互作用对SOCE具有正性调节作用[18]。因此, STIM1通过直接调节ASM内在收缩和间接控制过敏性哮喘炎症的关键特征来促进AHR, 从而使STIM1成为内皮源性收缩因子。
综上所述,本研究证明上皮细胞中STIM1调节ASM收缩和AHR, 其作用机制与激活Oria1介导的SOCE有关。这些数据为整合哮喘上皮细胞和ASM细胞相互作用以及增强AHR的机制提供了新见解,进而促进了对哮喘发病机制的深入理解。
-
图 1 STIM1在鼠支气管上皮细胞中高表达
A: 气道阻力的评估,各组通过flexiVent测量对乙酰甲胆碱(0~50 mg/mL)剂量增加的气道阻力,以记录增强暂停(n=6); B: 气道炎症的评估,苏木精-伊红染色观察支气管周围和肺泡区域的炎性细胞浸润; C: 各组之间的BALF中总白细胞计数; D: OVA组和OVA+sh-STIM1组BALF中白细胞的数量(NEU: 中性粒细胞; LYM: 淋巴细胞; MON: 单核细胞; EOS: 嗜酸性粒细胞); E、F: 各组支气管上皮细胞中STIM1表达的免疫荧光染色分析。与对照组相比, *P < 0.05, **P < 0.01, ***P < 0.001; 与OVA组相比, #P < 0.05, ###P < 0.001。
表 1 STIM1敲低对BALF中炎症因子释放影响(n=6)(x±s)
pg/mL 组别 IL-13 IL-4 IL-5 MCP-1 CON组 48.23±1.30 15.28±2.83 6.53±1.12 5.45±0.82 OVA组 137.65±15.42*** 27.62±3.25* 37.92±3.84** 38.72±4.67*** OVA+sh-STIM1组 71.49±8.74### 22.13±3.36 23.63±2.55# 14.91±2.51# IL: 白细胞介素; MCP-1: 单核细胞趋化蛋白。与对照组相比, * P < 0.05, * * P < 0.01, * * * P < 0.001; 与OVA组相比, #P < 0.05, ###P < 0.001。 -
[1] DRISCOLL A J, ARSHAD S H, BONT L, et al. Does respiratory syncytial virus lower respiratory illness in early life cause recurrent wheeze of early childhood and asthma Critical review of the evidence and guidance for future studies from a World Health Organization-sponsored meeting[J]. Vaccine, 2020, 38(11): 2435-2448. doi: 10.1016/j.vaccine.2020.01.020
[2] HUANG W C, LIU C Y, SHEN S C, et al. Protective effects of licochalcone A improve airway hyper-responsiveness and oxidative stress in a mouse model of asthma[J]. Cells, 2019, 8(6): 617. doi: 10.3390/cells8060617
[3] KOGAN V, MILLSTEIN J, LONDON S J, et al. Genetic-epigenetic interactions in asthma revealed by a genome-wide gene-centric search[J]. Hum Hered, 2018, 83(3): 130-152. doi: 10.1159/000489765
[4] JHA A, CHUNG W Y, VACHEL L, et al. Anoctamin 8 tethers endoplasmic Reticulum and plasma membrane for assembly of Ca2+ signaling complexes at the ER/PM compartment[J]. EMBO J, 2019, 38(12): e101452.
[5] SUNDARAM A, CHEN C, ISIK REED N, et al. Dual antagonists of α5β1/αvβ1 integrin for airway hyperresponsiveness[J]. Bioorg Med Chem Lett, 2020, 30(22): 127578. doi: 10.1016/j.bmcl.2020.127578
[6] ZHOU Y B, GU P, LI J, et al. Suppression of STIM1 inhibits the migration and invasion of human prostate cancer cells and is associated with PI3K/Akt signaling inactivation[J]. Oncol Rep, 2017, 38(5): 2629-2636. doi: 10.3892/or.2017.5961
[7] 刘芳. 西替利嗪滴剂与布地奈德吸入剂联用对哮喘急性发作患儿肺功能指标的影响[J]. 实用临床医药杂志, 2020, 24(3): 87-89, 93. doi: 10.7619/jcmp.202003025 [8] DU X Y, ZHI J, YANG D, et al. Research progress in the mechanism of calcium ion on contraction and relaxation of airway smooth muscle cells[J]. J Recept Signal Transduct Res, 2021, 41(2): 117-122. doi: 10.1080/10799893.2020.1806315
[9] MICHELUCCI A, GARCÍA-CASTAÑEDA M, BONCOMPAGNI S, et al. Role of STIM1/ORAI1-mediated store-operated Ca2+ entry in skeletal muscle physiology and disease[J]. Cell Calcium, 2018, 76: 101-115. doi: 10.1016/j.ceca.2018.10.004
[10] CONTE E, IMBRICI P, MANTUANO P, et al. Alteration of STIM1/Orai1-mediated SOCE in skeletal muscle: impact in genetic muscle diseases and beyond[J]. Cells, 2021, 10(10): 2722. doi: 10.3390/cells10102722
[11] ZHANG X Y, ZHAO Z X, MA L J, et al. The effects of transient receptor potential channel (TRPC) on airway smooth muscle cell isolated from asthma model mice[J]. J Cell Biochem, 2018, 119(7): 6033-6044. doi: 10.1002/jcb.26801
[12] MARONE G, GRANATA F, PUCINO V, et al. The intriguing role of interleukin 13 in the pathophysiology of asthma[J]. Front Pharmacol, 2019, 10: 1387. doi: 10.3389/fphar.2019.01387
[13] PARULEKAR A D, KAO C C, DIAMANT Z, et al. Targeting the interleukin-4 and interleukin-13 pathways in severe asthma: current knowledge and future needs[J]. Curr Opin Pulm Med, 2018, 24(1): 50-55. doi: 10.1097/MCP.0000000000000436
[14] HUANG Z Q, LIU J, ONG H H, et al. Interleukin-13 alters tight junction proteins expression thereby compromising barrier function and dampens rhinovirus induced immune responses in nasal epithelium[J]. Front Cell Dev Biol, 2020, 8: 572749. doi: 10.3389/fcell.2020.572749
[15] FAN H T, HUANG H J, HU L, et al. The activation of STIM1 mediates S-phase arrest and cell death in paraquat induced acute lung intoxication[J]. Toxicol Lett, 2018, 292: 123-135. doi: 10.1016/j.toxlet.2018.04.030
[16] MALI V, HADDOX S, BELMADANI S, et al. Essential role for smooth muscle cell stromal interaction molecule-1 in myocardial infarction[J]. J Hypertens, 2018, 36(2): 377-386. doi: 10.1097/HJH.0000000000001518
[17] JANULAITYTE I, JANUSKEVICIUS A, KALINAUSKAITE-ZUKAUSKE V, et al. Asthmatic eosinophils promote contractility and migration of airway smooth muscle cells and pulmonary fibroblasts in vitro[J]. Cells, 2021, 10(6): 1389. doi: 10.3390/cells10061389
[18] WANG Y X, WANG L, ZHENG Y M. Canonical transient potential receptor-3 channels in normal and diseased airway smooth muscle cells[J]. Adv Exp Med Biol, 2020, 1131: 471-487.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号