Long non-coding RNA CBR3-AS1 mediates the mechanism of cytarabine resistance in leukemia cells through the PI3K/AKT/mTOR/S6K pathway
-
摘要:目的
探讨长链非编码RNA (lncRNA)CBR3-AS1通过PI3K/AKT/mTOR/S6K通路介导急性髓细胞白血病(AML)细胞对阿糖胞苷耐药的可能机制。
方法在2个AML细胞株K562和HL-60中建立耐药模型,分别为K562-R和HL-60-R。逆转录-实时定量聚合酶链反应(RT-qPCR)法检测lncRNA CBR3-AS1在K562-R和HL-60-R中的表达情况。在K562和HL-60细胞株中,利用质粒过表达lncRNA CBR3-AS1; 在K562-R和HL-60-R细胞株中,利用siRNA敲低lncRNA CBR3-AS1表达,并计算阿糖胞苷的半数抑制浓度(IC50)。蛋白印迹法检测PI3K/AKT/mTOR/S6K通路激活情况。
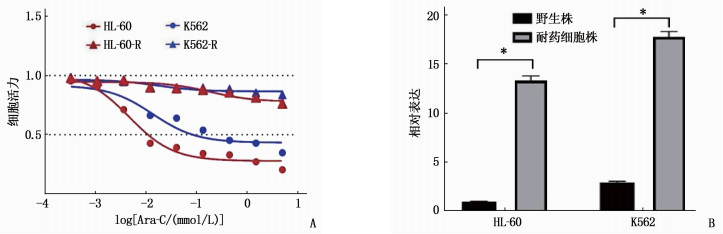
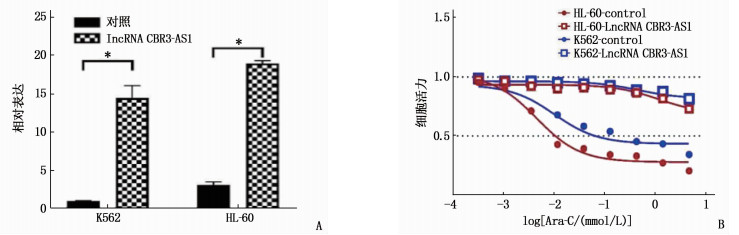
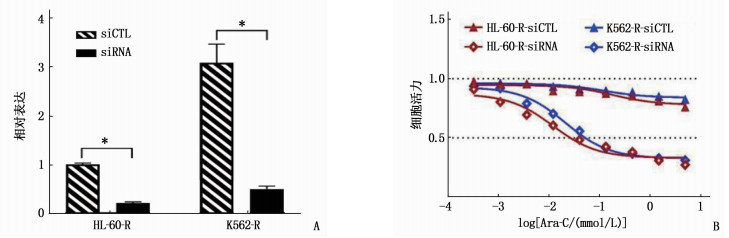
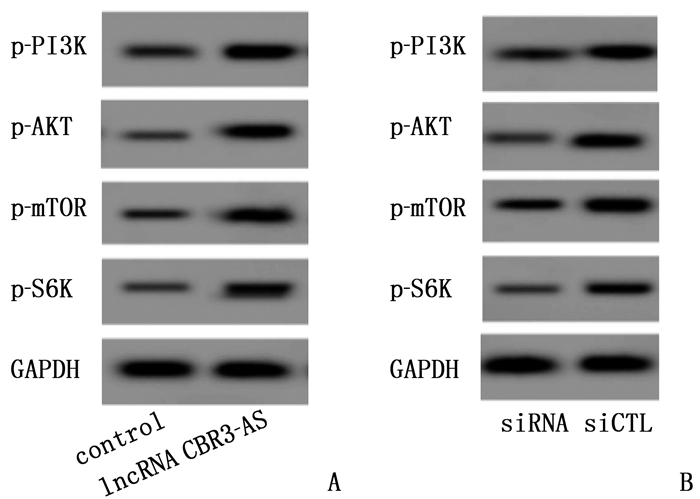
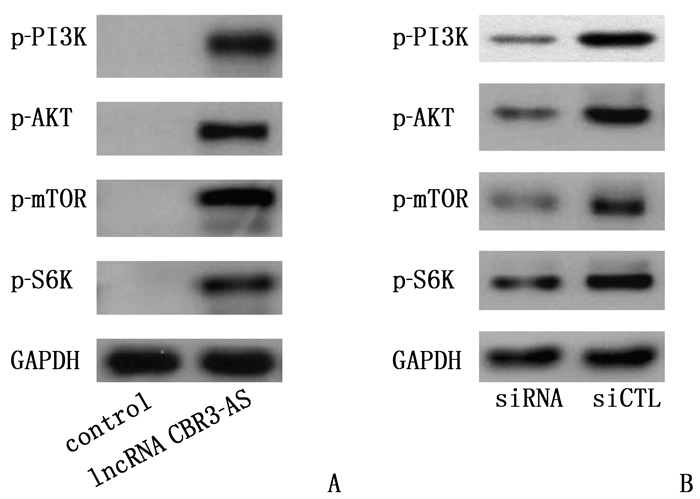
结果相较于K562和HL-60细胞株, K562-R和HL-60-R细胞株中lncRNA CBR3-AS1表达升高,差异有统计学意义(P < 0.05)。过表达lncRNA CBR3-AS1可提高阿糖胞苷IC50超过1 000 μmol/L(P < 0.05)。敲低lncRNA CBR3-AS1后,阿糖胞苷在耐药细胞株K562-R和HL-60-R中的IC50分别降低到21.27 μmol/L和12.10 μmol/L, 差异有统计学意义(P < 0.05)。过表达lncRNA CBR3-AS1显著提高磷酸肌醇3激酶(PI3K)、AKT、哺乳动物雷帕霉素靶蛋白(mTOR)、S6K蛋白的磷酸化水平(P < 0.05); 敲低lncRNA CBR3-AS1显著降低PI3K、AKT、mTOR、S6K蛋白的磷酸化水平(P < 0.05)。
结论lncRNA CBR3-AS1可能通过激活PI3K/AKT/mTOR/S6K通路介导AML细胞对阿糖胞苷的耐药。
-
关键词:
- 长链非编码RNA CBR3-AS1 /
- 急性髓细胞白血病 /
- 阿糖胞苷 /
- 耐药 /
- PI3K/AKT/mTOR/S6K通路
Abstract:ObjectiveTo investigate the possible mechanism of long non-coding RNA (lncRNA) CBR3-AS1 mediating cytarabine resistance in acute myeloid leukemia (AML) cells through PI3K/AKT/mTOR/S6K pathway.
MethodsDrug resistance models were established in two AML cell strains K562 and HL-60, named as K562-R and HL-60-R, respectively. Reverse transcription quantitative real-time polymerase chain reaction (RT-qPCR) was used to detect the expression of lncRNA CBR3-AS1 in K562-R and HL-60-R. LncRNA CBR3-AS1 was overexpressed by plasmids in the K562 and HL-60 cell strains; lncRNA CBR3-AS1 expression was knocked down by siRNA in K562-R and HL-60-R cell strains, and the 50% inhibitory concentration (IC50) of cytarabine was calculated. K562-R and HL-60-R cell lines, siRNA was used to knock down the expression of lncRNA CBR3-AS1. Western blot was used to detect the activation of PI3K/AKT/mTOR/S6K pathway.
ResultsCompared with K562 and HL-60 cell strains, the expressions of lncRNA CBR3-AS1 in K562-R and HL-60-R cell strains were significantly increased (P < 0.05). Overexpression of lncRNA CBR3-AS1 increased the IC50 of cytarabine to over 1 000 μmol/L (P < 0.05). After knock down lncRNA CBR3-AS1, the IC50 of cytarabine in drug-resistant cell strains K562-R and HL-60-R were significantly reduced to 21.27 μmol/L and 12.10 μmol/L (P < 0.05), respectively. Overexpression of lncRNA CBR3-AS1 significantly increased the phosphorylation levels of PI3K, AKT, mammalian target of rapamycin (mTOR) and S6K proteins (P < 0.05). Knockdown lncRNA CBR3-AS1 significantly reduced the phosphorylation levels of PI3K, AKT, mTOR and S6K proteins (P < 0.05).
ConclusionLncRNA CBR3-AS1 may mediate the resistance of AML cells to cytarabine by activating the PI3K/AKT/mTOR/S6K pathway.
-
胃癌是消化系统常见的恶性肿瘤,在中国病死率居高不下,其治疗以外科手术为主,为保证术后效果、预防复发,常辅助化疗[1-2]。因肿瘤消耗、机体代谢需求变大、外科手术创伤等因素引起营养素大量消耗,易致机体发生营养不良[3-4]。部分肿瘤患者直接死于营养不良,而非肿瘤疾病本身[5]。营养不良是胃癌化疗患者的常见问题,如果不及时干预,可导致不良结局事件的发生。故规范科学的营养支持是胃癌化疗患者治疗不可或缺的部分。营养状况筛查与评估工具可客观评估机体营养状况,明确其可能的影响因素,并加以针对性干预。准确预测胃癌化疗患者营养不良风险对改善其预后具有重要意义。列线图常用于临床事件个体化风险预测[6]。相关研究[7]利用列线图模型预测慢性心力衰竭患者营养不良风险,预测效率和临床适用性较好。鉴于此,本研究通过分析胃癌化疗患者营养不良的危险因素,构建预测胃癌化疗患者营养不良风险的列线图模型。
1. 资料与方法
1.1 一般资料
选择2021年1月—2022年12月在本院肿瘤科接受完整化疗的152例患者为研究对象。纳入标准: ①行胃癌根治性切除术者; ②接受完整术后化疗者; ③年龄>18岁者; ④自愿接受本研究问卷调查者。排除标准: ①出现腹腔或肝脏等远处转移者; ②术前接受新辅助化疗者; ③患精神病,或无法正常沟通者; ④入院之前已发生营养不良者; ⑤合并其他肠胃疾病史患者。本研究获本院伦理委员会批准。
1.2 方法
1.2.1 收集资料
收集患者年龄、性别、文化程度、居住地、家庭月收入、合并糖尿病、合并高血压、肿瘤部位、分化程度、分期、术式、T分期和神经脉管侵犯、区域淋巴结转移、化疗期间肠外营养支持、总蛋白缺乏、低蛋白血症、贫血、食欲、恶心、呕吐、口干、便秘、腹泻、早饱等资料。
1.2.2 化疗方案
本研究对象选择的化疗方案主要有2种。①奥沙利铂(85 mg, 静脉滴注)+5-氟尿嘧啶(400 mg, 静脉滴注)+亚叶酸钙(200 mg, 静脉滴注)。②奥沙利铂(130 mg, 静脉滴注)+替吉奥(40 mg, 口服)。
1.2.3 化疗护理管理
护士遵医嘱给予患者胃肠减压、补液、禁食等对症护理措施,同时加强患者的血压、心率等生命体征监测; 给予患者口腔护理,妥善固定胃管,避免打折、滑脱、弯曲等现象发生,并详细记录患者引流液的数量、质量、颜色。同时保持病房干净,维持适宜的温度及湿度,并鼓励患者运动,增加运动量及日常活动的频次,为患者制订饮食食谱等。
1.2.4 营养状况评估
营养状况评估采用自评-主观全面评定量表(PG-SGA)。该量表包括患者自我评估、医务人员评估2个部分,分值为0分(营养状况好)至35分(营养状况差)[8]。依据定量评估结果分为营养良好组(得分<4分)与营养不良组(得分≥4分)[9-10]。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。计数资料采用[n(%)]描述,行卡方检验。以胃癌化疗患者营养状况为因变量(营养良好=0, 营养不良=1), 将其年龄、性别、文化程度、居住地等为自变量纳入胃癌化疗患者营养不良的相关影响因素分析,采用单因素分析相关因素,将单因素分析差异有统计学意义的变量纳入二分类Logistic回归分析,以明确胃癌化疗患者营养不良的独立危险因素。将胃癌化疗患者营养不良的独立危险因素引入R3.6.3软件及rms程序包,构建预测胃癌化疗患者营养不良发生风险的列线图模型,使用受试者工作特征(ROC)曲线、校准曲线验证列线图模型的区分度与一致性; 采用Hosmer-Lemeshow拟合优度检验评价列线图模型的拟合优度。P<0.05表示差异有统计学意义。
2. 结果
2.1 一般资料分析
152例胃癌化疗患者中, 106例营养不良,发生率为69.74%。营养良好组(n=46)与营养不良组(n=106)在合并糖尿病、合并高血压、肿瘤部位、分化程度、分期、术式、T分期、有无神经脉管侵犯、有无区域淋巴结转移、有无总蛋白缺乏、有无食欲、有无呕吐、有无口干、有无便秘、有无腹泻方面比较,差异无统计学意义(P>0.05), 在年龄、性别、文化程度、居住地、家庭月收入、化疗期间肠外营养支持、有无低蛋白血症、有无贫血、有无恶心、有无早饱方面比较,差异有统计学意义(P<0.05)。见表 1。
表 1 2组一般资料分析[n(%)]一般资料 分类 营养良好组(n=46) 营养不良组(n=106) χ2 P 年龄 <60岁 35(76.09) 55(51.89) 7.779 0.005 ≥60岁 11(23.91) 51(48.11) 性别 男 24(52.17) 77(72.64) 6.028 0.014 女 22(47.83) 29(27.36) 文化程度 小学及以下 8(17.39) 38(35.85) 11.394 0.010 初中 9(19.57) 32(30.19) 高中/中专 20(43.48) 26(24.53) 大专及以上 9(19.57) 10(9.43) 居住地 城市 32(69.57) 50(47.17) 6.476 0.011 农村 14(30.43) 56(52.83) 家庭月收入 <3 000元人民币 7(15.22) 28(26.42) 8.429 0.015 3 000~5 000元人民币 18(39.13) 54(50.94) >5 000元人民币 21(45.65) 24(22.64) 合并糖尿病 是 32(69.57) 62(58.49) 1.667 0.197 否 14(30.43) 44(41.51) 合并高血压 是 29(63.04) 59(55.66) 0.717 0.397 否 17(36.96) 47(44.34) 肿瘤部位 贲门 12(26.09) 23(21.70) 0.389 0.823 胃体 24(52.17) 57(53.77) 胃窦 10(21.74) 26(24.53) 分化程度 中分化 6(13.04) 10(9.43) 0.444 0.505 低分化 40(86.96) 96(90.57) 分期 Ⅰ期 10(21.74) 26(24.53) 0.593 0.743 Ⅱ期 14(30.43) 26(24.53) Ⅲ期 22(47.83) 54(50.94) 术式 近端胃切除术 1(2.17) 2(1.89) 0.151 0.927 全胃切除术 27(58.70) 59(55.66) 远胃切除术 18(39.13) 45(42.45) T分期 T1~T3 39(84.78) 96(90.57) 1.080 0.299 T4 7(15.22) 10(9.43)) 神经脉管侵犯 有 33(71.74) 72(67.92) 0.219 0.640 无 13(28.26) 34(32.08) 区域淋巴结转移 有 34(73.91) 70(66.04) 0.921 0.337 无 12(26.09) 36(33.96) 化疗期间肠外营养支持 是 31(67.39) 45(42.45) 7.980 0.005 否 15(32.61) 61(57.55) 总蛋白缺乏 无 39(84.78) 79(74.53) 1.942 0.163 有 7(15.22) 27(25.47) 低蛋白血症 无 45(97.83) 90(84.91) 5.391 0.020 有 1(2.17) 16(15.09) 贫血 无 28(60.87) 44(41.51) 4.823 0.028 有 18(39.13) 62(58.49) 食欲 无 4(8.70) 23(21.70) 3.713 0.054 有 42(91.30) 83(78.30) 恶心 无 43(93.48) 82(77.36) 5.706 0.017 有 3(6.52) 24(22.64) 呕吐 无 42(91.30) 91(85.85) 0.873 0.350 有 4(8.70) 15(14.15) 口干 无 44(95.65) 93(87.74) 2.260 0.133 有 2(4.35) 13(12.26) 便秘 无 45(97.83) 94(88.68) 3.432 0.064 有 1(2.17) 12(11.32) 腹泻 无 43(93.48) 101(95.28) 0.210 0.647 有 3(6.52) 5(4.72) 早饱 无 45(97.83) 87(82.08) 6.965 0.008 有 1(2.17) 19(17.92) 2.2 多因素Logistic回归分析
Logistic回归分析结果显示,性别男(95%CI: 1.232~6.292, P=0.014)、化疗期间未肠外营养支持(95%CI: 1.528~7.781, P=0.003)、有低蛋白血症(95%CI: 1.193~76.786, P=0.033)、有早饱(95%CI: 1.259~82.652, P=0.030)是胃癌化疗患者营养不良的独立危险因素,见表 2。
表 2 多因素Logistic回归分析因素 赋值说明 B S. E Wals P Exp (B) 95%CI 下限 上限 性别(1) 女=0, 男=1 1.024 0.416 6.056 0.014 2.784 1.232 6.292 化疗期间肠外营养支持(1) 是=0, 否=1 1.238 0.415 8.882 0.003 3.448 1.528 7.781 有无低蛋白血症(1) 无=0, 有=1 2.259 1.062 4.521 0.033 9.572 1.193 76.786 有无早饱(1) 无=0, 有=1 2.322 1.067 4.733 0.030 10.201 1.259 82.652 常量 — -0.697 0.396 3.096 0.078 0.498 — — 2.3 列线图模型建立
将性别、化疗期间肠外营养支持、有无低蛋白血症、有无早饱4项预测指标引入R软件,构建预测胃癌化疗患者营养不良发生风险的列线图模型,见图 1。预测胃癌化疗患者营养不良发生风险的列线图模型评分表见表 3。
表 3 列线图模型评分表分列线图中的预测变量 分类 列线图评分/分 性别 女 0 男 44.2 化疗期间肠外营养支持 是 0 否 52.9 低蛋白血症 无 0 有 97.3 早饱 无 0 有 100.0 2.4 内部验证
区分度评价: 列线图模型预测的ROC曲线下面积为0.757(95%CI: 0.680~0.833), 见图 2。一致性评价: 校准曲线斜率接近1, 且Hosmer-Lemeshow拟合优度检验显示χ2=5.834, P=0.442。
3. 讨论
营养是维持正常生命活动的物质基础[11]。对胃癌患者而言,良好的营养状况可提高机体耐受性,保证外科手术、辅助化疗的顺利实施,还可改善其预后。化疗是治疗癌症的有效手段之一,通过全身或局部使用化学药物可有效杀灭肿瘤细胞[12]。机体营养状态与化疗往往是相互影响的,营养不良可降低机体对化疗的耐受性,而临床使用的化疗药物通常具有细胞毒性,常引起胃肠反应等,不利于机体营养摄入,加剧营养不良程度[13-14]。本研究采用PG-SGA评估胃癌化疗患者的营养状况,结果显示, 152例胃癌化疗患者中, 106例营养不良,发生率为69.74%, 这与毛玲红等[15]进行的关于肺癌患者化疗期间营养不良调查研究结果接近。可见,胃癌化疗患者营养不良发生率较高。
本研究采用Logistic回归分析筛选影响胃癌化疗患者营养不良的危险因素,结果显示,性别男(95%CI: 1.232~6.292, P=0.014)、化疗期间未肠外营养支持(95%CI: 1.528~7.781, P=0.003)、有低蛋白血症(95%CI: 1.193~76.786, P=0.033)、有早饱(95%CI: 1.259~82.652, P=0.030)是胃癌化疗患者营养不良的独立危险因素。本研究构建的预测胃癌化疗患者营养不良风险的列线图模型,基于上述胃癌化疗患者营养不良的4项独立危险因素。性别是胃癌化疗患者营养不良影响因素,这可能是因为男性胃癌高发,且部分男性有经常加班熬夜、酗酒、抽烟等不良生活习惯。肠外营养支持系指经静脉途径提供机体所需营养物质,是消化道肿瘤患者常用的营养支持方法。本研究认为,化疗期间未肠外营养支持是胃癌化疗患者营养不良影响因素,这与张瑜等[16]、屈清荣等[17]研究结果一致,提示要加强胃癌化疗患者的肠外营养支持,以改善机体营养状况。本研究中,有低蛋白血症是胃癌化疗患者营养不良的独立危险因素,与毕研霞等[18]研究结果类似。推测其原因可能是:白蛋白能有效清除活性氧,增强机体免疫力,白蛋白合成进程受到显著抑制,将引起机体低蛋白血症,导致细胞免疫损伤,增加营养不良风险。胃癌化疗期间要重视患者机体白蛋白检测,依据检测结果适时补充能量、蛋白质,以满足机体所需营养。早饱,也就是功能性消化不良,此种情况下胃排空速度较缓,食物摄入量远低于正常进食量[19]。根据本研究分析结果,早饱对胃癌化疗患者营养状况有直接影响,为胃癌化疗患者营养不良的独立危险因素之一。分析原因可能与食物摄入量远低于正常进食量有关,长期食物摄入量过少将无法满足机体营养所需,营养供给不足自然会引起营养不良。因此,护理人员可对胃癌化疗患者进行必要的饮食指导,可通过健康讲座、宣传手册等形式加深患者对健康饮食知识的了解。本研究采用校准曲线验证列线图模型的一致性,采用Hosmer-Lemeshow拟合优度检验评价列线图模型的拟合优度,结果显示χ2=5.834, P=0.442。本研究构建的列线图预测模型的预测结果与胃癌化疗患者营养不良实际发生率较吻合,准确度较高。ROC曲线下面积为0.757(95%CI: 0.680~0.833), 说明该列线图模型区分度较好,可有效预测胃癌化疗患者营养不良。
列线图模型可节省计算过程,且更易理解,能够直观看到胃癌化疗患者营养不良的独立危险因素及相应权重,以便引起临床医护人员的重视,根据各预测变量展开针对性干预,还能够强化胃癌化疗患者对营养不良的认知,进而改善其营养状态。根据本研究分析结果,临床上应对性别男、化疗期间未肠外营养支持、有低蛋白血症、有早饱等因素的胃癌化疗患者给予重视,进行科学营养支持,以减少胃癌化疗患者营养不良的发生。本研究尚存在以下不足: ①仅在一家医院收集病例,样本量较小,不同地区患者营养状况可能不同; ②纳入分析的影响因素有限; ③列线图模型构建后未进行外部验证。后续还需通过多中心、大样本的临床前瞻性横断面研究进行验证,并纳入更多影响因素进行分析以筛选出更高效的预测指标,进一步优化列线图模型并进行外部验证。
综上所述,男性、化疗期间未肠外营养支持、有低蛋白血症、有早饱是胃癌化疗患者营养不良的独立危险因素,基于此构建的预测列线图模型具有良好的区分度与一致性,可为临床评估胃癌化疗患者营养不良风险提供依据。
-
-
[1] ESTEY E H. Acute myeloid leukemia: 2019 update on risk-stratification and management[J]. Am J Hematol, 2018, 93(10): 1267-1291. doi: 10.1002/ajh.25214
[2] LANCET J E, UY G L, CORTES J E, et al. CPX-351 (cytarabine and daunorubicin) liposome for injection versus conventional cytarabine plus daunorubicin in older patients with newly diagnosed secondary acute myeloid leukemia[J]. J Clin Oncol, 2018, 36(26): 2684-2692. doi: 10.1200/JCO.2017.77.6112
[3] STIEF S M, HANNEFORTH A L, WESER S, et al. Loss of KDM6A confers drug resistance in acute myeloid leukemia[J]. Leukemia, 2020, 34(1): 50-62. doi: 10.1038/s41375-019-0497-6
[4] AROUA N, BOET E, GHISI M, et al. Extracellular ATP and CD39 activate cAMP-mediated mitochondrial stress response to promote cytarabine resistance in acute myeloid leukemia[J]. Cancer Discov, 2020, 10(10): 1544-1565. doi: 10.1158/2159-8290.CD-19-1008
[5] DONG X M, XU X, GUAN Y P. LncRNA LINC00899 promotes progression of acute myeloid leukaemia by modulating miR-744-3p/YY1 signalling[J]. Cell Biochem Funct, 2020, 38(7): 955-964. doi: 10.1002/cbf.3521
[6] MVLLER V, OLIVEIRA-FERRER L, STEINBACH B, et al. Interplay of lncRNA H19/miR-675 and lncRNA NEAT1/miR-204 in breast cancer[J]. Mol Oncol, 2019, 13(5): 1137-1149. doi: 10.1002/1878-0261.12472
[7] 熊雄, 焉正庆, 张爱军. 长链非编码RNA CBR3-AS1在乳腺癌中的表达及其功能[J]. 中国普通外科杂志, 2019, 28(11): 1374-1380. doi: 10.7659/j.issn.1005-6947.2019.11.009 [8] 黄杰, 胡华, 蒋林. 长链非编码RNA CBR3-AS1在骨肉瘤中的表达及意义[J]. 南京医科大学学报: 自然科学版, 2020, 40(1): 56-61, 71. https://www.cnki.com.cn/Article/CJFDTOTAL-NJYK202001011.htm [9] WANG C, LI L L, LI M Y, et al. Silencing long non-coding RNA XIST suppresses drug resistance in acute myeloid leukemia through down-regulation of MYC by elevating microRNA-29a expression[J]. Mol Med, 2020, 26(1): 114. doi: 10.1186/s10020-020-00229-4
[10] ZHANG H, LIU L, CHEN L L, et al. Long noncoding RNA DANCR confers cytarabine resistance in acute myeloid leukemia by activating autophagy via the miR-874-3P/ATG16L1 axis[J]. Mol Oncol, 2021, 15(4): 1203-1216. doi: 10.1002/1878-0261.12661
[11] ZHANG M, WANG Y, JIANG L Y, et al. LncRNA CBR3-AS1 regulates of breast cancer drug sensitivity as a competing endogenous RNA through the JNK1/MEK4-mediated MAPK signal pathway[J]. J Exp Clin Cancer Res, 2021, 40(1): 41. doi: 10.1186/s13046-021-01844-7
[12] 刘亮, 刘洪涛, 李医明. lncRNA CBR3-AS1靶向调控miR-5195-3p促进胃癌细胞增殖、迁移及侵袭[J]. 胃肠病学和肝病学杂志, 2021, 30(6): 612-616. doi: 10.3969/j.issn.1006-5709.2021.06.003 [13] 吕波, 朱新锋, 蔡常春, 等. 长链非编码RNA CBR3-AS1在胆管癌中的表达及其临床意义[J]. 中国普通外科杂志, 2019, 28(8): 960-966. https://www.cnki.com.cn/Article/CJFDTOTAL-ZPWZ201908009.htm [14] 徐瑞, 李丽娜, 王文娟. Hippo信号通路介导PTEN调节PI3K/AKT/mTOR信号通路影响肝癌细胞增殖能力[J]. 山西医科大学学报, 2020, 51(12): 1277-1283. https://www.cnki.com.cn/Article/CJFDTOTAL-SXYX202012001.htm [15] 粟燕云, 吴梅青, 刘振芳, 等. 紫杉醇对FLT3-ITD突变阳性急性髓系白血病细胞株MOLM-13增殖与凋亡的影响[J]. 广西医科大学学报, 2021, 38(4): 699-703. https://www.cnki.com.cn/Article/CJFDTOTAL-GXYD202104013.htm [16] TORKASHVAND S, BASI, AJDARKOSH H, et al. Long non-coding RNAs expression in breast cancer: CBR3-AS1 LncRNA as a sensitive biomarker[J]. Asian Pac J Cancer Prev, 2021, 22(9): 2897-2902. doi: 10.31557/APJCP.2021.22.9.2897
[17] GUAN Y, YANG J, LIU X M, et al. Long noncoding RNA CBR3 antisense RNA 1 promotes the aggressive phenotypes of non small cell lung cancer by sponging microRNA 509 3p and competitively upregulating HDAC9 expression[J]. Oncol Rep, 2020, 44(4): 1403-1414.
-
期刊类型引用(1)
1. 邱换换,葛高琪,郭瑾,刘建芳,路亚婉. 基于主观整体营养评估量表评分的营养干预对结直肠癌患者化疗期营养摄入和生活质量的影响. 国际医药卫生导报. 2025(01): 136-140 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号