Value of feature selection and subgroup analysis basedon radiomics in predicting prognosis of patients with lung adenocarcinoma
-
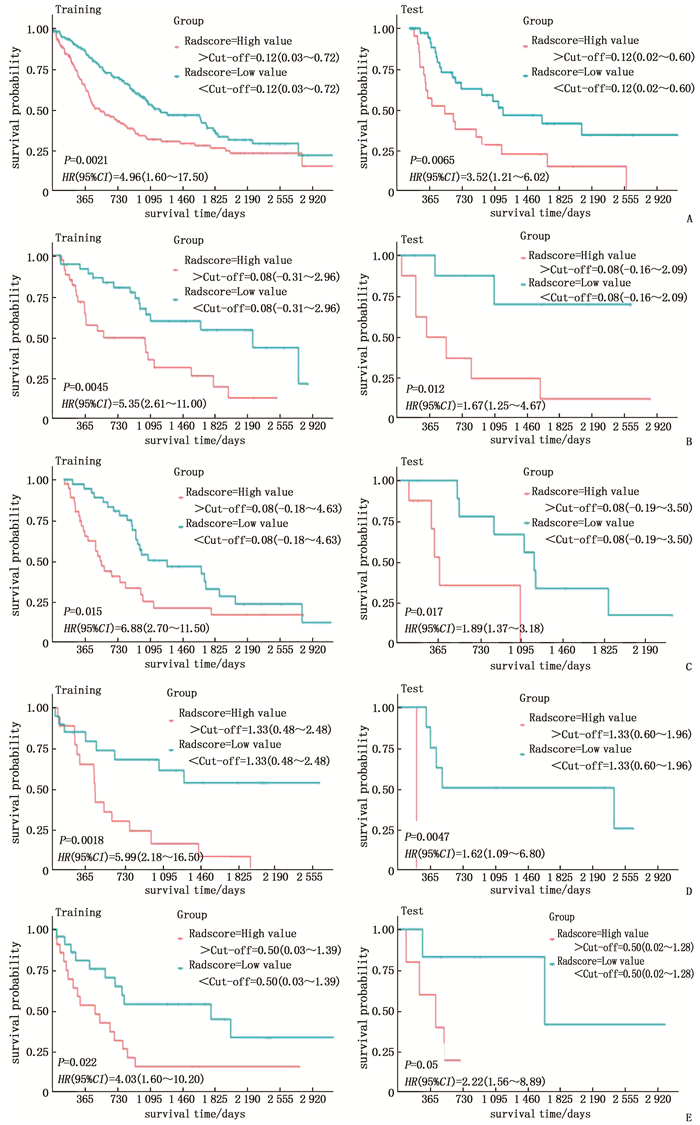
摘要:目的 探讨基于放射组学的特征选择和亚组分析对肺腺癌患者预后的预测价值。方法 选取293例接受放疗的肺腺癌患者,从胸部CT图像中提取107个放射学特征(14个形状特征、18个一阶统计特征和75个纹理特征)。分析3种不同的特征选择(FS)方法[即重测和多重分割(FS1)、皮尔逊相关分析(FS2)以及FS1和FS2相结合的方法(FS3)]对生存预测性能的影响。对各个T分期进行亚组分析,采用一致性指数(C-index)和Kaplan-Meier法评估预后表现。亚组分析采用5倍交叉验证以确保模型的可靠性。结果 在放射学模型的训练和测试数据集中,FS2的C-index是所有选择方法中最高的(分别为0.64、0.61)。同样,FS2在组合模型的训练和测试数据集中的所有选择方法中具有最高的C-index(分别为0.65、0.63)。亚组分析表明,基于T分期的预测模型对测试数据集的C-index高于基于全数据的预测模型。结论 特征选择方法在一定程度上提高了生存预测的性能,基于T分期的亚组预测模型可以提高预测性能。Abstract:Objective To explore the value of feature selection and subgroup analysis based on radiomics in predicting prognosis of patients with lung adenocarcinoma.Methods A total of 293 lung adenocarcinoma patients with radiotherapy were selected, and 107 radiological features (14 shape features, 18 first-order statistical features and 75 texture features) were extracted from chest CT images. The effects of three different feature selection (FS) methods[retest and multiple segmentation (FS1), Pearson correlation analysis (FS2) and the combination of FS1 and FS2 (FS3)]on survival prediction performance were analyzed. Subgroup analysis was performed for each T stage, and the prognostic performance was evaluated by consistency index (C-index) and Kaplan-Meier method. Quintuple cross validation was used in subgroup analysis to ensure the reliability of the model.Results In the training and test data sets of radiology model, the C-index of FS2 was the highest among all the selection methods (values were 0.64 and 0.61 respectively). Similarly, FS2 showed the highest C-index (values were 0.65 and 0.63, respectively) among all the selection methods in the training and test data sets of the combined model. Subgroup analysis showed that the C-index of the prediction model based on T stage was higher than that based on the full data.Conclusion Feature selection method improves the performance of survival prediction to a certain extent, and the subgroup prediction model based on T stage can improve the prediction performance.
-
Keywords:
- radiomics /
- feature selection /
- prognosis analysis /
- subgroup analysis /
- lung adenocarcinoma
-
复发性流产是妇产科常见疾病,包括生化妊娠,其在育龄女性中的发病率约为5%, 且呈逐渐升高趋势[1-3]。随着自然流产次数的增多,复发性流产的发生风险也会随之升高。引发复发性流产的原因较多,常见原因包括子宫发育不良、感染、精神紧张等。60%~70%患者的发病原因不明[4-5]。复发性流产会导致妊娠结局变差,影响患者的心理健康。抗凝治疗是该病的首选疗法。阿司匹林为常用抗凝药,可有效抑制血栓形成,且能改善炎性浸润,但单用阿司匹林效果欠佳[6-7]。低分子肝素钙对改善血栓前状态有较好的临床疗效[8]。本研究探讨低分子肝素钙联合小剂量阿司匹林在复发性流产患者中的应用效果,现报告如下。
1. 资料与方法
1.1 一般资料
选取2021年1月—2023年9月本院妇产科收治的180例复发性流产患者为研究对象,按照随机数表法分成对照组与观察组,每组90例。对照组年龄20~44岁,平均(30.88±4.47)岁; 体质量52~75 kg, 平均(58.26±4.58) kg; 流产次数2~5次,平均(3.46±0.90)次。观察组年龄20~45岁,平均(30.92±4.43)岁; 体质量52~75 kg, 平均(58.30±4.55) kg; 流产次数2~5次,平均(3.51±0.87)次。2组上述资料比较,差异无统计学意义(P>0.05)。本研究已获得医院伦理委员会审批(2021-TZFY-008-01)。
纳入标准: ①年龄20~45岁者; ②经临床检查证实,满足《复发性流产抗血栓药物治疗中国专家共识》[9]中复发性流产的诊断规定者; ③夫妻双方染色体核型正常; ④患者或家属对研究知晓,自愿加入。排除标准: ①血常规、凝血功能障碍者; ②生殖道感染或畸形者; ③主要脏器疾病者; ④对本研究药物具有禁忌证者; ⑤感染性疾病者; ⑥癌症者; ⑦瘢痕子宫者; ⑧带器宫内妊娠者; ⑨精神病、意识障碍者。
1.2 方法
2组均于备孕前3个月至妊娠12周服用叶酸片(江西制药,国药准字H36020872), 0.4 g/次, 1次/d; 确认为宫内妊娠后,肌注绒毛膜促性素(Merck Serono S. p. A., 注册证号S20110045) 1 000 U/次, 1次/d, 用药1~2周; 肌注黄体酮注射液(昆药集团,国药准字H53020916), 20 mg/次, 1次/d, 用药至妊娠10周后改为口服黄体酮胶囊(浙江仙琚,国药准字H20041902), 100 mg/次,2次/d, 用药至妊娠12周。口服维生素E片(上海新黄河,国药准字H31021028), 100 mg/次, 3次/d, 用药至妊娠20周。对照组给予小剂量阿司匹林治疗: 口服阿司匹林片(哈药集团,国药准字H23021185), 0.75 g/次, 1次/d, 用药至妊娠20周。观察组给予低分子肝素钙联合小剂量阿司匹林治疗: 经脐周皮下注射低分子肝素钙注射液(深圳赛保尔,国药准字H20060190), 3 000 IU/次(0.6 mL), 1次/d, 用药至妊娠20周; 小剂量阿司匹林用药方法同对照组。2组用药期间,每周检测1次凝血功能、血小板计数等,出现异常则酌情减少药量或停药,保胎失败则终止妊娠。2组均随访至终止妊娠。
1.3 观察指标
血栓前状态: 纤溶酶原激活抑制剂-1(PAI-1)、组织型纤溶酶原激活物(t-PA)、抗凝血酶Ⅲ(AT-Ⅲ)、蛋白S(PS), 于治疗前、妊娠20周晨起空腹采血,分别应用酶联免疫吸附法、显色底物法、凝固法进行检测。
凝血功能: 凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、血小板计数(PLT), 于治疗前、妊娠20周晨起空腹采血,应用全自动血凝分析仪进行检测。
激素水平: 绒毛膜促性腺激素(HCG)、雌二醇(E2)、孕酮(P),于治疗前、妊娠20周晨起空腹采血,应用生化分析仪进行检测。
妊娠结局: 流产、早产死胎、早产活婴、足月分娩,早产活婴、足月分娩视为保胎成功,计算保胎成功率。
不良反应: 观察2组不良反应发生情况,计算不良反应总发生率。
1.4 统计学分析
采用SPSS 22.0软件进行数据分析,符合正态分布的计量资料以(x±s)表示,行t检验,计数资料以[n(%)]表示,行χ2检验。P<0.05为差异有统计学意义。
2. 结果
2.1 血栓前状态比较
治疗后, 2组PAI-1、t-PA降低, AT-Ⅲ、PS升高,且观察组PAI-1、t-PA低于对照组, AT-Ⅲ、PS均高于对照组,差异有统计学意义(P<0.05)。见表 1。
表 1 血栓前状态比较(x±s)指标 时点 对照组(n=90) 观察组(n=90) PAI-1/(μg/L) 治疗前 42.46±7.65 42.49±7.63 妊娠20周 26.15±5.37* 20.83±4.22*# t-PA/(μg/L) 治疗前 13.16±1.97 13.20±1.94 妊娠20周 11.06±1.12* 10.48±0.92*# AT-Ⅲ/% 治疗前 82.20±7.51 82.25±7.48 妊娠20周 98.01±8.35* 107.78±9.21*# PS/% 治疗前 83.94±10.34 83.99±10.31 妊娠20周 90.92±11.21* 98.64±12.04*# PAI-1: 纤溶酶原激活抑制剂-1;
t-PA: 组织型纤溶酶原激活物; AT-Ⅲ: 抗凝血酶Ⅲ; PS: 蛋白S。
与治疗前比较, *P<0.05; 与对照组比较, #P<0.05。2.2 凝血功能比较
治疗后, 2组PT、TT、APTT升高, FIB、PLT降低,且观察组PT、TT、APTT高于对照组, FIB、PLT低于对照组,差异有统计学意义(P<0.05)。见表 2。
表 2 凝血功能比较(x±s)指标 时点 对照组(n=90) 观察组(n=90) PT/s 治疗前 10.73±1.67 10.77±1.63 妊娠20周 11.48±1.75* 12.57±1.81*# TT/s 治疗前 14.27±1.23 14.30±1.25 妊娠20周 15.62±1.50* 16.48±1.56*# APTT/s 治疗前 25.34±4.15 25.31±4.18 妊娠20周 26.72±4.52* 28.45±4.77*# FIB/(g/L) 治疗前 4.55±0.52 4.57±0.50 妊娠20周 3.98±0.44* 3.52±0.40*# PLT/(×109/L) 治疗前 204.23±24.57 204.30±24.51 妊娠20周 179.34±18.93* 160.40±18.23*# PT: 凝血酶原时间; TT: 凝血酶时间;
APTT: 活化部分凝血活酶时间;
FIB: 纤维蛋白原; PLT: 血小板计数。
与治疗前比较, *P<0.05; 与对照组比较, #P<0.05。2.3 激素水平比较
治疗后, 2组HCG、E2、P升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表 3。
表 3 激素水平比较(x±s)组别 HCG/(IU/L) E2/(ng/L) P/(μg/L) 治疗前 妊娠20周 治疗前 妊娠20周 治疗前 妊娠20周 对照组(n=90) 992.43±101.74 6 452.87±734.23* 365.83±39.75 414.76±33.40* 8.94±2.17 22.63±2.49* 观察组(n=90) 990.84±105.82 6 873.28±790.40*# 364.59±40.17 460.68±38.37*# 8.76±2.21 28.55±3.04*# HCG: 绒毛膜促性腺激素; E2: 雌二醇; P: 孕酮。与治疗前比较, *P<0.05; 与对照组比较, #P<0.05。 2.4 妊娠结局比较
观察组保胎成功率高于对照组,差异有统计学意义(P<0.05)。见表 4。
表 4 妊娠结局比较[n(%)]组别 流产 早产死胎 早产活婴 足月分娩 保胎成功 对照组(n=90) 18(20.00) 7(7.78) 10(11.11) 55(61.11) 65(72.22) 观察组(n=90) 9(10.00) 2(2.22) 15(16.67) 64(71.11) 79(87.78)* 与对照组比较, *P<0.05。 2.5 不良反应比较
2组不良反应总发生率比较,差异无统计学意义(P>0.05)。见表 5。
表 5 不良反应比较[n(%)]组别 皮下瘀斑 牙龈出血 胃肠道反应 血小板减少 合计 对照组(n=90) 2(2.22) 1(1.11) 2(2.22) 1(1.11) 6(6.67) 观察组(n=90) 2(2.22) 1(1.11) 1(1.11) 0 4(4.44) 3. 讨论
复发性流产是自然流产的形式之一,多数患者胚胎着床后初期终止发育,导致流产[10]。随着工作与生活压力的增加,女性复发性流产的发生率呈逐渐升高的发展趋势。复发性流产可导致妊娠失败、长期不育或永久性不育,还会影响夫妻关系、婆媳关系及家庭和睦。因此,对该病进行早期诊断、治疗非常重要。复发性流产的发病机制非常复杂,可能与多种因素有关,其中血栓形成和凝血功能异常在复发性流产的发病中起重要作用。
阿司匹林可降低血小板环氧酶活性,预防血栓形成[11-13], 纠正异常子宫血流灌注,改善胎盘血液循环[14]。动物实验研究[15-16]发现,阿司匹林过量使用有致畸风险,但阿司匹林750~1 500 mg/d给药为安全、有效的。故本研究采用小剂量阿司匹林(0.75 g/d)用药。低分子肝素钙是一种抗凝血药物,通过抑制凝血酶的活性,阻止血栓形成。其具有较高的生物利用度和较长的半衰期,因此可以通过皮下注射给药,方便患者使用。低分子肝素钙还可增加AT-Ⅲ的活性,从而进一步增强抗凝血能力,且出血风险小,不易和血小板结合,可有效预防血小板减少[17]。低分子肝素能够达到较好的保胎效果[18-19]。探讨阿司匹林与低分子肝素联合用药的效果具有重要意义[20-21]。
血栓前状态通过影响胎盘血供,导致胎儿缺血、缺氧,甚至停育,最终影响妊娠结局。低分子肝素钙和小剂量阿司匹林的联用可以产生协同效应,从而更好地改善复发性流产患者的血栓前状态和凝血功能。本研究显示,观察组治疗后的PAI-1、t-PA均显著低于对照组,且AT-Ⅲ、PS均显著高于对照组,提示观察组患者的血栓前状态得到了更好的调节,血栓形成的风险较低,分析原因与低分子肝素钙具有抑制血栓形成作用有直接关系。妊娠后,凝血时间会缩短,且呈高凝状态,以防产后出血,但若高凝状态异常且持续时间过长,则易引发血栓,导致胚胎缺氧、缺血,因此改善患者的凝血功能非常有必要。本研究中,观察组治疗后的PT、TT、APTT显著较高,且FIB、PLT显著较低,提示观察组患者的凝血功能改善效果更好,说明联合治疗能够更有效调节患者的凝血功能。
此外,低分子肝素钙联合小剂量阿司匹林还可以调节激素水平。在妊娠过程中,激素平衡对于维持妊娠的稳定性非常重要。HCG是诊断早期妊娠的主要参考依据。在妊娠初期, HCG的水平会迅速上升,并在妊娠8~11周达到峰值,然后逐渐下降。E2和P是由卵巢产生的激素,在妊娠过程中起着重要调节作用。随着妊娠黄体和胎盘的形成, E2和P的表达水平逐渐升高。E2主要由卵泡细胞产生,在妊娠早期起着促进子宫内膜增厚和胚胎着床的作用。P主要由黄体和胎盘产生,在妊娠早期起着维持妊娠的作用,有助于子宫内膜的稳定和胚胎的发育。复发性流产患者由于滋养层萎缩,其激素水平会显著低于正常妊娠孕妇。本研究显示,观察组治疗后的HCG、E2、P显著更高,提示观察组患者的激素水平较高,说明联合治疗可以更好调节患者的激素水平,提高妊娠成功率。观察组保胎成功率显著高于对照组,进一步证实联合治疗的应用优势及安全性。这可能与低分子肝素钙联合小剂量阿司匹林可改善患者的凝血功能、调节激素水平以及预防血栓形成有关。在治疗复发性流产时,低分子肝素钙联合小剂量阿司匹林的优势不仅在于其治疗效果,还在于其安全性。本研究结果显示,观察组和对照组的不良反应发生率相近,说明低分子肝素钙联合小剂量阿司匹林治疗的安全性较好。但不同患者对药物的反应可能存在差异,因此需密切监测患者的情况,并根据其具体情况进行调整。
综上所述,低分子肝素钙联合小剂量阿司匹林治疗复发性流产患者具有显著的临床效果,可有效改善患者的血栓前状态、凝血功能和激素水平,提高妊娠结局和保胎成功率,且具有较好的安全性。但本研究存在一定的不足,本研究病例数较少,结果可能存在偏倚,因此仍需扩大样本量以进一步验证。
-
表 1 2组患者一般资料比较(x±)[n(%)]
一般资料 训练组
(n=235)测试组
(n=58)年龄/岁 70.23±16.34 68.44±15.87 性别 男 195(82.99) 47(81.03) 女 40(17.02) 11(18.97) T分期 T1 74(31.49) 19(32.20) T2 77(32.77) 19(32.76) T3 39(16.60) 10(17.24) T4 45(19.15) 10(17.24) N分期 N0 87(37.02) 22(37.93) N1 29(12.34) 7(12.07) N2 82(34.89) 20(34.48) N3 37(15.74) 9(15.52) M分期 M0 201(85.53) 50(86.21) M1 34(14.47) 8(13.79) 临床分期 Ⅰ期 66(28.09) 17(29.31) Ⅱ期 20(8.51) 5(8.62) Ⅲ期 116(49.36) 28(48.28) Ⅳ期 33(14.04) 8(13.79) 化疗状态 是 107(45.53) 26(44.83) 否 128(54.47) 32(55.17) 生存时间/d 591.38±156.21 595.16±153.47 生存状态 生存 101(42.97) 24(41.38) 死亡 134(57.02) 34(58.62) 表 2 训练组和测试组中不同模型的预测性能
模型构建 特征总数 训练数据集 测试数据集 C-index HR(95%CI) C-index HR(95%CI) 放射学模型 FS1 23 0.63 1.55(1.30~1.85) 0.60 0.95(0.82~1.10) FS2 28 0.64 3.96(2.43~6.45) 0.61 1.87(0.88~3.99) FS3 9 0.62 1.84(0.17~2.19) 0.60 1.06(0.01~2.08) 组合模型 FS1+临床 31 0.64 2.22(0.58~3.22) 0.62 1.20(0.45~2.87) FS2+临床 36 0.65 4.75(2.99~7.56) 0.63 2.24(1.13~4.36) FS3+临床 17 0.64 2.62(0.90~3.96) 0.62 0.94(0.19~2.32) 表 3 各亚组预后预测表现(x±)
组别 放射学模型 组合模型 训练模型 测试模型 训练模型 测试模型 全组(n=293) 0.63±0.01 0.62±0.03 0.65±0.01 0.64±0.04 T1组(n=93) 0.66±0.03 0.66±0.04 0.70±0.02 0.68±0.03 T2组(n=96) 0.64±0.03 0.63±0.05 0.66±0.02 0.65±0.02 T3组(n=49) 0.68±0.02 0.65±0.03 0.68±0.04 0.66±0.06 T4组(n=55) 0.65±0.02 0.63±0.04 0.72±0.02 0.70±0.06 -
[1] MOLINA J R, YANG P, CASSIVI S D, et al. Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship[J]. Mayo Clin Proc, 2008, 83(5): 584-590. doi: 10.1016/S0025-6196(11)60735-0
[2] LIANG W, ZHANG L, JIANG G, et al. Development and validation of a nomogram for predicting survival in patients with resected non-small-cell lung cancer[J]. J Clin Oncol, 2015, 33(8): 861-869. doi: 10.1200/JCO.2014.56.6661
[3] RAMI-PORTA R, ASAMURA H, GOLDSTRAW P. Predicting the prognosis of lung cancer: the evolution of tumor, node and metastasis in the molecular age-challenges and opportunities[J]. Transl Lung Cancer Res, 2015, 4(4): 415-423.
[4] AERTS H J, VELAZQUEZ E R, LEIJENAAR R T, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach[J]. Nat Commun, 2014, 5: 4006-4015. doi: 10.1038/ncomms5006
[5] GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: Images Are More than Pictures, They Are Data[J]. Radiology, 2016, 278(2): 563-568. doi: 10.1148/radiol.2015151169
[6] LIU J, CUI J, LIU F, et al. Multi-subtype classification model for non-small cell lung cancer based on radiomics: SLS model[J]. Med Phys, 2019, 46(7): 3091-3098. doi: 10.1002/mp.13551
[7] ZHU X, DONG D, CHEN Z, et al. Radiomic signature as a diagnostic factor for histologic subtype classification of non-small cell lung cancer[J]. Eur Radiol, 2018, 28(7): 2772-2784. doi: 10.1007/s00330-017-5221-1
[8] ABEL S, HASAN S, WHITE R, et al. Stereotactic ablative radiotherapy(SABR) in early stage non-small cell lung cancer: Comparing survival outcomes in adenocarcinoma and squamous cell carcinoma[J]. Lung Cancer, 2019, 128: 127-135. doi: 10.1016/j.lungcan.2018.12.022
[9] FUKUI T, TANIGUCHI T, KAWAGUCHI K, et al. Comparisons of the clinicopathological features and survival outcomes between lung cancer patients with adenocarcinoma and squamous cell carcinoma[J]. Gen Thorac Cardiovasc Surg, 2015, 63(9): 507-517. doi: 10.1007/s11748-015-0564-5
[10] YANG L, YANG J, ZHOU X, et al. Development of a radiomics nomogram based on the 2D and 3D CT features to predict the survival of non-small cell lung cancer patients[J]. Eur Radiol, 2019, 29(5): 2196-2205. doi: 10.1007/s00330-018-5770-y
[11] CHADDAD A, DESROSIERS C, TOEWS M, et al. Predicting survival time of lung cancer patients using radiomic analysis[J]. Oncotarget, 2017, 8(61): 104393-104399. doi: 10.18632/oncotarget.22251
[12] YANG J, WU Q, XU L, et al. Integrating tumor and nodal radiomics to predict lymph node metastasis in gastric cancer[J]. Radiother Oncol, 2020, 150: 89-95. doi: 10.1016/j.radonc.2020.06.004
[13] KADOYA N, TANAKA S, KAJIKAWA T, et al. Homology-based radiomic features for prediction of the prognosis of lung cancer based on CT-based radiomics[J]. Med Phys, 2020, 47(5): 2197-2203. doi: 10.1002/mp.14104
[14] VAN BAARDWIJK A, BOSMANS G, BOERSMA L, et al. PET-CT-based auto-contouring in non-small-cell lung cancer correlates with pathology and reduces interobserver variability in the delineation of the primary tumor and involved nodal volumes[J]. Int J Radiat Oncol Biol Phys, 2007, 68(3): 771-786. doi: 10.1016/j.ijrobp.2006.12.067
[15] MORI M, PASSONI P, INCERTI E, et al. Training and validation of a robust PET radiomic-based index to predict distant-relapse-free-survival after radio-chemotherapy for locally advanced pancreatic cancer[J]. Radiother Oncol, 2020, 153: 258-264. doi: 10.1016/j.radonc.2020.07.003
[16] LI H, ZHANG R, WANG S, et al. CT-Based Radiomic Signature as a Prognostic Factor in Stage Ⅳ ALK-Positive Non-small-cell Lung Cancer Treated With TKI Crizotinib: A Proof-of-Concept Study[J]. Front Oncol, 2020, 10: 57-65. doi: 10.3389/fonc.2020.00057
[17] LIN P, YANG P F, CHEN S, et al. A Delta-radiomics model for preoperative evaluation of Neoadjuvant chemotherapy response in high-grade osteosarcoma[J]. Cancer Imaging, 2020, 20(1): 7-12. doi: 10.1186/s40644-019-0283-8
[18] SUN W, JIANG M, DANG J, et al. Effect of machine learning methods on predicting NSCLC overall survival time based on Radiomics analysis[J]. Radiat Oncol, 2018, 13(1): 197-204. doi: 10.1186/s13014-018-1140-9
[19] LEGER S, ZWANENBURG A, PILZ K, et al. A comparative study of machine learning methods for time-to-event survival data for radiomics risk modelling[J]. Sci Rep, 2017, 7(1): 13206-13212. doi: 10.1038/s41598-017-13448-3
[20] ZHOU X, YI Y, LIU Z, et al. Radiomics-Based Preoperative Prediction of Lymph Node Status Following Neoadjuvant Therapy in Locally Advanced Rectal Cancer[J]. Front Oncol, 2020, 10: 604-611. doi: 10.3389/fonc.2020.00604
[21] OUYANG M L, XIA H W, XU M M, et al. Prediction of occult lymph node metastasis using SUV, volumetric parameters and intratumoral heterogeneity of the primary tumor in T1-2N0M0 lung cancer patients staged by PET/CT[J]. Ann Nucl Med, 2019, 33(9): 671-682. doi: 10.1007/s12149-019-01375-4
[22] LIU C, GONG J, YU H, et al. A CT-Based Radiomics Approach to Predict Nivolumab Response in Advanced Non-Small-Cell Lung Cancer[J]. Front Oncol, 2021, 11: 544339. doi: 10.3389/fonc.2021.544339
-
期刊类型引用(3)
1. 蒋春芳,吴晓萍,沈云士. 门诊处方前置审核系统对生殖中心用药合理化分析. 医药前沿. 2025(03): 129-133 .  百度学术
百度学术
2. 郭秀荣. 低分子肝素钠联合阿司匹林治疗复发性流产的安全性评价. 中外医疗. 2024(33): 27-30 .  百度学术
百度学术
3. 刘娟,马汝婵. 烯丙雌醇联合低分子肝素钠治疗对复发性流产患者子宫血流灌注和凝血功能的影响. 智慧健康. 2024(35): 63-66 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号