Expression levels and clinical significance of microR-495-3p and Holliday junction recognition protein in thyroid cancer
-
摘要:目的 检测甲状腺癌组织中微小RNA-495-3p(miR-495-3p)、Holliday交叉识别蛋白(HJURP)的表达水平及临床意义。方法 选择行手术根治术切除并经病理检查确诊的甲状腺癌石蜡包埋标本67例及正常甲状腺组织石蜡包埋标本42例为研究对象,利用荧光定量聚合酶链反应(PCR)技术检测miR-495-3p水平,采用免疫组织化学法检测HJURP阳性表达情况,分析miR-495-3p、HJURP水平与甲状腺癌患者临床病理参数的关系。采用Kaplan-Meier生存曲线分析甲状腺癌组织中miR-495-3p、HJURP水平与患者预后的关系; 采用COX回归分析探讨影响甲状腺癌患者预后的不良因素。结果 HJURP在癌组织中的阳性表达率为62.69%, 在正常甲状腺组织中的阳性表达率为26.19%, 差异有统计学意义(χ2=13.765, P < 0.01); miR-495-3p在甲状腺癌组织和正常甲状腺组织中的相对表达量分别为(0.76±0.21)、(1.26±0.40), 差异有统计学意义(t=8.539, P < 0.001); miR-495-3p、HJURP水平与甲状腺患者临床分期、淋巴结转移有关(P < 0.05); 临床分期Ⅲ~Ⅳ、发生淋巴结转移的甲状腺癌患者miR-495-3p的水平更低, HJURP蛋白阳性表达更高; miR-495-3p高表达患者3年累积生存率高于miR-495-3p低表达组,差异有统计学意义(χ2=8.478, P=0.004); HJURP阳性患者3年累积生存率为57.14%, 低于HJURP阴性患者的92.00%, 差异有统计学意义差异有统计学意义(χ2=9.093, P=0.003)。多因素分析结果显示,临床分期、淋巴结转移、miR-495-3p、HJURP是影响甲状腺癌患者预后不良的独立危险因素(P < 0.05)。结论 甲状腺癌组织中miR-495-3p表达下调, HJURP表达上调,与肿瘤临床分期、淋巴结转移及预后有关,可能参与了肿瘤细胞的分化、迁移等过程。
-
关键词:
- 甲状腺癌 /
- 微小RNA-495-3p /
- Holliday交叉识别蛋白 /
- 表达 /
- 临床意义
Abstract:Objective To detect the expression levels of microRNA-495-3p (miR-495-3p) and Holliday junction recognition protein (HJURP) in thyroid cancer tissues and explore their clinical significance.Methods A total of 67 paraffin-embedded specimens of thyroid cancer diagnosed by pathological examination and 42 paraffin-embedded specimens of normal thyroid tissue were selected as research objects. The miR-495-3p level was detected with fluorescence quantitative polymerase chain reaction (PCR) technology, the positive expression of HJURP was detected by immunohistochemistry, the relationships of miR-495-3p, HJURP levels with clinicopathological parameters in patients with thyroid cancer were analyzed. Kaplan-Meier survival curve was used to analyze the relationships of the levels of miR-495-3p and HJURP in thyroid cancer with the prognosis ofpatients; COX regression analysis was used to explore the adverse factors affecting the prognosis of thyroid cancer patients.Results The positive expression rate of HJURP in cancer tissues was 62.69%, and was 26.19% in normal thyroid tissues (P < 0.01); the relative expression of miR-495-3p in thyroid cancer tissue and normal thyroid tissue was (0.76±0.21) and (1.26±0.40), respectively(t=8.539, P < 0.001); the levels of miR-495-3p and HJURP were related to the clinical stageand lymph node metastasis of thyroid patients (P < 0.05). The levels of miR-495-3p in patients with thyroid cancer in clinical stage of Ⅲ to Ⅳ and lymph nodemetastasis were lower, and their positive expression of HJURP protein were higher; the 3-year cumulative survival rates of patients with miR-495-3p high expression were significantly higher than in those with miR-495-3p low expression (χ2=8.478, P=0.004); the 3-year cumulative survival rate of patients with positive HJURP was significantly lower than that in those with negative HJURP (57.14% versus 92.00%, χ2=9.093, P=0.003); the results of multivariate analysis showed that clinical staging, lymph node metastasis, miR-495-3p, and HJURP were independent risk factors affecting the poor prognosis of patients with thyroid cancer (P < 0.05).Conclusion In tissues of thyroid cancer, the expression of miR-495-3p is down-regulated, and the expression of HJURP is up-regulated, which are related to the clinical stage of the tumor, lymph node metastasis and prognosis, and may be involved in the differentiation and migration of tumor cells. -
甲状腺癌是内分泌系统常见恶性肿瘤,多发于甲状腺滤泡上皮,是目前发病率增长速度最快的恶性肿瘤之一。甲状腺癌主要包括分化型、未分化型和其他类型,不同类型甲状腺癌患者预后差异较大,且伴不同程度的术后并发症,并累及不同器官[1]。因此,早期诊断对甲状腺癌的防治具有重要意义。微小RNA(miRNA)是一类长度约22个核苷酸的非编码小RNA分子,通过与目的基因的3′非翻译端结合来抑制mRNA翻译或降解mRNA, 在转录水平上调节基因表达,参与细胞增殖、分化、凋亡等过程[2]。研究[3-4]发现,微小RNA-495-3p(miR-495-3p)在多种肿瘤中表达下调,可能发挥抑癌作用,在甲状腺癌中的表达关系尚未见报道。Holliday交叉识别蛋白(HJURP)是一种组蛋白H3伴侣,被认为是DNA结合及磷酸化的关键因子,可促进染色体分离和细胞有丝分裂[5]。HJURP在肝癌、肾细胞癌、胰腺癌等多肿瘤中表达异常升高,并与不良临床结局相关,可能作为指示肿瘤发展的潜在生物标记物[6-7]。本研究检测甲状腺癌组织miR-495-3p、HJURP表达水平及表达关系并探讨其临床意义,现将结果报告如下。
1. 资料与方法
1.1 临床资料
选择2016年1月—2018年1月行手术根治术并经病理检查确诊为甲状腺癌石蜡包埋标本及正常甲状腺组织石蜡包埋标本为研究对象,共纳入67例甲状腺癌组织标本和42例正常甲状腺组织标本。纳入标准: ①临床资料和病理资料完整者; ②均为首次诊断并治疗的患者,且术前未接受其他任何抗肿瘤治疗; ③患者及家属知情并同意本研究。排除标准: ①合并其他甲状腺疾病者; ②合并近期感染或传染性疾病的患者; ③继发性甲状腺癌者; ④合并其他恶性肿瘤者。67例甲状腺癌患者中,男26例,女41例,年龄43~67岁,平均(55.60±4.63)岁, ≥55岁39例, < 55岁28例; 肿瘤直径≥2 cm 37例, < 2 cm 30例; 病理类型: 乳头状癌31例,滤泡状癌16例,髓样癌12例,未分化癌8例; TNM分期: Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期35例; 合并淋巴结转移42例,无淋巴结转移25例。正常甲状腺患者男18例,女24例,年龄42~62岁,平均(54.86±4.82)岁。2组研究的年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。本研究获得伦理委员会批准。
1.2 主要仪器及试剂
TRIzol试剂(批号: 20170322, 购自美国Sigma公司)、反转录试剂盒、实时荧光定量聚合酶链反应(qRT-PCR)扩增试剂盒(批号: 20161209、20170501, 均购自Thermo Scientific公司)、UV-1800PC紫外可见分光光度计(购自上海美谱达)、HJURP兔抗人多克隆抗体(批号: 20170118, 购自上海群己生物科技有限公司)、DAB酶底物显色剂、中杉金桥SPN-9002免疫组化染色试剂盒(批号: 20170714、20160425,均购自北京百奥莱博科技有限公司)。
1.3 方法
1.3.1 荧光定量PCR技术检测miR-495-3p水平
利用TRIzol试剂提取组织总RNA, 紫外可见分光光度计检测总RNA浓度及纯度,以OD260/OD280值在1.8~2.2范围内为纯度较好。以RNA为模板,使用反转录试剂盒将其反转录为cDNA, 并进行PCR扩增,操作步骤及注意事项均严格按照说明书执行。miR-495-3p以U6为内参,引物序列由上海生工生物工程公司合成。miR-495-3p上游引物5′-GGGGAAACAAACATGGTGCAC-3′, 下游引物5′-CAGTGCGTGTCGTGGAGT-3′; U6上游引物3′-CTCGCTTCGGCAGCACA-5′, 下游引物3′-AACGCTTCACGAATTTGCGT-5′。反应条件: 95 ℃预变性10 min, 95 ℃变性10 s, 62 ℃延伸30 s, 40个循环。用2-∆∆Ct法计算miR-495-3p水平。
1.3.2 免疫组织化学法检测HJURP
将石蜡包埋组织以4 μm连续切片,常规脱蜡、水化后,用3%过氧化氢孵育5~10 min, 以消除内源性过氧化物酶活性; 蒸馏水冲洗后,用磷酸盐缓冲溶液(PBS)浸泡5 min; 抗原热修复、封闭、滴加一抗、孵育、洗涤、再次封闭后滴加二抗,再次洗涤,滴加辣根过氧化物酶标记链霉亲和素, PBS冲洗3次, DBA显色,自来水充分冲洗,复染,封片。所有操作步骤均按照试剂盒说明书步骤进行。利用PBS缓冲液代替一抗作为阴性对照。
1.3.3 结果判定
HJURP以细胞质或细胞膜出现黄色或黄棕色颗粒为表达阳性,采用双盲法对所有切片进行观察评分。每张切片随机选取5个高倍镜视野,根据染色强度和阳性细胞所占百分比进行评分: ①按染色强度评分。细胞不着色记0分,淡黄色记1分,黄色或黄棕色记2分,棕色或棕褐色记3分; ②按阳性细胞百分比评分。无阳性细胞记0分,阳性细胞比例 < 25%记1分, 26%~50%记2分, >50%记3分。2种方法评分的乘积>3分即为阳性, ≤3分即为阴性。
1.3.4 随访
从手术之日开始对患者进行门诊或打电话随访,以患者死亡或2021年1月31日结束随访,统计患者累积生存情况,以分析甲状腺癌组织中miR-495-3p、HJURP水平与患者预后的关系。
1.4 统计学方法
采用SPSS 22.0统计学软件进行数据录入与分析,计量资料均符合正态分布,以均数±标准差表示,2组比较采用t检验; 计数资料、分类资料用率表示,行卡方检验。Kaplan-Meier生存曲线分析甲状腺癌组织中miR-495-3p、HJURP水平与患者预后的关系, COX回归分析影响甲状腺癌患者预后不良的因素。P < 0.05为差异有统计学意义。
2. 结果
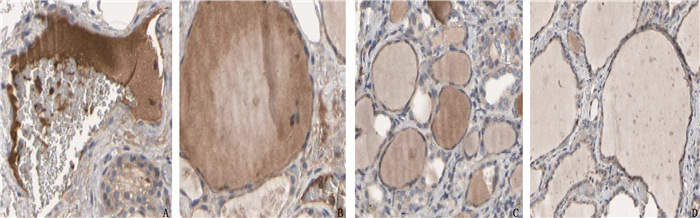
2.1 免疫组化结果
HJURP在癌组织中的阳性表达率为62.69%(42/67), 在正常甲状腺组织中的阳性表达率为26.19%(11/42), 差异有统计学意义(χ2=13.765, P < 0.01), 见图 1。
2.2 甲状腺癌组织和正常甲状腺组织中miR-495-3p水平比较
miR-495-3p在甲状腺癌组织和正常甲状腺组织中的相对表达量分别为(0.76±0.21)、(1.26±0.40), 差异有统计学意义(t=8.539, P < 0.001)。
2.3 miR-495-3p、HJURP水平与甲状腺癌患者临床病理参数的关系
以甲状腺癌患者miR-495-3p水平中位数(0.75)为分界点,将患者分为miR-495-3p高表达组(35例)和miR-495-3p低表达组(32例),根据HJURP的表达结果及将患者分为HJURP阳性组(n=42)和HJURP阴性组(n=25)。结果显示, miR-495-3p、HJURP水平与甲状腺患者年龄、性别、病理类型、分化程度无显著相关性(P>0.05), 与临床分期、淋巴结转移相关(P < 0.05)。临床分期Ⅲ~Ⅳ、发生淋巴结转移的甲状腺癌患者miR-495-3p水平更低,HJURP蛋白阳性表达越高,见表 1。
表 1 miR-495-3p、HJURP水平与甲状腺癌患者临床病理参数的关系临床病理参数 n miR-495-3p χ2/P HJURP χ2/P 高表达组(n=35) 低表达组(n=32) 阳性组(n=42) 阴性组(n=25) 年龄 0.651/0.420 0.632/0.427 ≥55岁 39 22 17 26 13 < 55岁 28 13 15 16 12 性别 0.631/0.427 0.132/0.716 男 26 12 14 17 9 女 41 23 18 25 16 病理类型 5.824/0.121 2.018/0.569 乳头状癌 31 20 11 22 9 滤泡状癌 16 6 10 9 7 髓样癌 12 7 5 6 6 未分化癌 8 2 6 5 3 分化程度 1.712/0.191 1.848/0.174 低分化 20 8 12 15 5 中/高分化 47 27 20 27 20 临床分期 4.399/0.036 6.547/0.011 Ⅰ~Ⅱ期 32 21 11 15 17 Ⅲ~Ⅳ期 35 14 21 27 8 淋巴结转移 6.242/0.012 5.954/0.015 有 42 17 25 31 11 无 25 18 7 11 14 miR-495-3p: 微小RNA-495-3p; HJURP: Holliday交叉识别蛋白。 2.4 甲状腺癌组织中miR-495-3p、HJURP水平与患者预后的关系
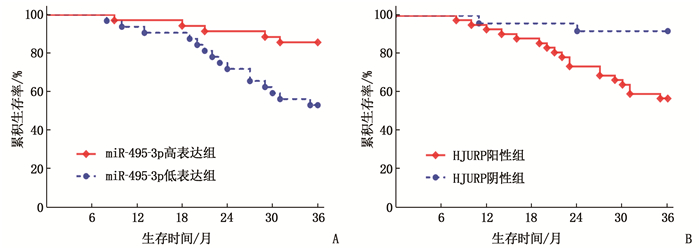
随访3年,甲状腺癌患者累积生存率为70.15%(47/67)。miR-495-3p高表达组患者3年累积生存率为85.71%(30/35), 高于miR-495-3p低表达组的53.13%(17/32), 差异有统计学意义(χ2=8.478, P=0.004); HJURP阳性组患者3年累积生存率57.14%(24/42), 低于HJURP阴性组92.00%(23/25), 差异有统计学意义(χ2=9.093, P=0.003)。见图 2。
2.5 甲状腺癌患者预后不良的因素分析
根据甲状腺癌患者术后3年复发转移情况,将患者发生复发转移定义为预后不良,未发生复发转移定义为预后良好。单因素分析结果显示,病理类型、分化程度、临床分期、淋巴结转移、miR-495-3p、HJURP是影响甲状腺癌患者预后不良的危险因素(P < 0.05); 多因素分析结果显示,临床分期、淋巴结转移、miR-495-3p、HJURP是影响甲状腺癌患者预后不良的独立危险因素(P < 0.05), 见表 2。
表 2 影响甲状腺癌患者预后不良的因素分析变量 单因素 多因素 HR 95%CI P HR 95%CI P 年龄 1.167 0.697~1.954 0.557 - - - 性别 1.108 0.705~1.742 0.657 - - - 病理类型 1.984 1.015~3.878 0.045 1.746 0.921~3.308 0.087 分化程度 1.875 1.017~3.456 0.044 1.812 0.995~3.301 0.052 临床分期 2.483 1.265~4.873 0.008 2.176 1.181~4.011 0.013 淋巴结转移 2.684 1.384~5.206 0.003 2.419 1.240~4.720 0.009 miR-495-3p 2.356 1.205~4.606 0.012 2.219 1.102~4.467 0.025 HJURP 2.439 1.257~4.731 0.008 2.175 1.074~4.405 0.031 miR-495-3p: 微小RNA-495-3p; HJURP: Holliday交叉识别蛋白。 3. 讨论
甲状腺癌约占所有癌症的1%, 在地方性结节性甲状腺肿流行地区,甲状腺癌的发病率尤其高[8]。目前,甲状腺癌的发病原因尚未明确,但从流行病学、实验室研究及临床观察发现,可能与放射性损伤、甲状腺病变、碘摄取异常、遗传因素等有关。近年来研究[9]发现,原癌基因的激活突变或抑癌基因的异常失活在侵袭性甲状腺肿瘤的发生、发展中起重要作用, miRNAs可能成为包括甲状腺癌在内的多种癌症类型特定临床病理特征相关的生物标志物。研究[10]发现, hsa-miR-139-5p的外源表达显著降低了间变性甲状腺癌细胞的迁移和增殖,在持续复发及局部转移相关的原发肿瘤中表达下调,通过HNRNPF介导的选择性剪接作用参与甲状腺癌信号通路和肿瘤毒力调节机制。miRDB网站(http://www.mirdb.org/)预测发现,miR-495-3p与HJURP存在结合位点,提示可能在甲状腺癌发生及病情进展过程中共同发挥作用。本研究通过检测miR-495-3p在甲状腺癌组织中表达水平发现,miR-495-3p在癌组织中的表达水平低于正常甲状腺组织,推测miR-495-3p在甲状腺癌中可能发挥抑癌基因作用,进一步分析miR-495-3p水平与甲状腺癌患者临床病理资料的关系发现, miR-495-3p水平高低与患者年龄、性别、病理类型、分化程度无关,而临床分期Ⅲ~Ⅳ、发生淋巴结转移的甲状腺癌患者miR-495-3p水平较临床分期Ⅰ~Ⅱ期、无淋巴结转移的患者更低,表明miR-495-3p水平异常表达与甲状腺癌患者肿瘤细胞增殖分化、迁移侵袭等有关,但具体作用机制尚不清楚。研究[11-12]发现, miR-495-3p在结肠癌、前列腺癌中亦表达下调,可通过与其下游靶基因结合抑制肿瘤细胞增殖、迁移及侵袭作用,并受各自信号通路调节,由此推测miR-495-3p在甲状腺癌中发挥相似的抑癌作用,并通过激活信号通路参与甲状腺癌的发生、发展过程。
HJURP是G1早期阶段着丝粒CENP-A沉积的唯一伴侣,已被证明是DNA结合和磷酸化的关键调节因子,参与染色体分离、细胞分裂等调控作用[13]。研究[14]发现, DNA损伤诱导后, HJURP表达显著上调,与DNA修复因子发挥协同作用。HJURP在肿瘤细胞中的作用越来越受到关注。本研究结果显示,甲状腺癌组织中HJURP阳性表达率高于正常甲状腺组织,表达水平与肿瘤临床分期、淋巴结转移有关,与HJURP在其他肿瘤中的表达趋势一致[15-16]。研究[17]认为, HJURP通过上调鞘氨醇基酶1(SPHK1)参与肝癌细胞迁移和侵袭过程,且高表达HJURP预示肝细胞癌患者较低无病生存期和较高微血管浸润风险。生存分析发现, miR-495-3p高表达和HJURP阴性的甲状腺癌患者具有更高的3年累积生存率,提示检测miR-495-3p、HJURP可能对评估甲状腺癌患者预后有帮助。进一步分析发现,临床分期、淋巴结转移、miR-495-3p、HJURP是影响甲状腺癌患者预后不良的独立危险因素,临床分期Ⅲ~Ⅳ期、发生淋巴结转移、miR-495-3p低表达、HJURP高表达使甲状腺癌患者术后发生复发转移的风险增加,表明miR-495-3p、HJURP可能作为甲状腺癌患者预后的潜在生物指标。
综上所述,在甲状腺癌组织中miR-495-3p表达下调, HJURP表达上调,表达水平与临床分期、淋巴结转移有关,可能作为甲状腺癌患者预后不良的潜在标志物,具体作用方式有待进一步研究。miR-495-3p、HJURP表达水平与甲状腺癌发生及患者预后的关系尚不能定论,下一步需增加细胞功能或动物模型实验,继续探讨两者是否有治疗甲状腺癌的潜在价值。
-
表 1 miR-495-3p、HJURP水平与甲状腺癌患者临床病理参数的关系
临床病理参数 n miR-495-3p χ2/P HJURP χ2/P 高表达组(n=35) 低表达组(n=32) 阳性组(n=42) 阴性组(n=25) 年龄 0.651/0.420 0.632/0.427 ≥55岁 39 22 17 26 13 < 55岁 28 13 15 16 12 性别 0.631/0.427 0.132/0.716 男 26 12 14 17 9 女 41 23 18 25 16 病理类型 5.824/0.121 2.018/0.569 乳头状癌 31 20 11 22 9 滤泡状癌 16 6 10 9 7 髓样癌 12 7 5 6 6 未分化癌 8 2 6 5 3 分化程度 1.712/0.191 1.848/0.174 低分化 20 8 12 15 5 中/高分化 47 27 20 27 20 临床分期 4.399/0.036 6.547/0.011 Ⅰ~Ⅱ期 32 21 11 15 17 Ⅲ~Ⅳ期 35 14 21 27 8 淋巴结转移 6.242/0.012 5.954/0.015 有 42 17 25 31 11 无 25 18 7 11 14 miR-495-3p: 微小RNA-495-3p; HJURP: Holliday交叉识别蛋白。 表 2 影响甲状腺癌患者预后不良的因素分析
变量 单因素 多因素 HR 95%CI P HR 95%CI P 年龄 1.167 0.697~1.954 0.557 - - - 性别 1.108 0.705~1.742 0.657 - - - 病理类型 1.984 1.015~3.878 0.045 1.746 0.921~3.308 0.087 分化程度 1.875 1.017~3.456 0.044 1.812 0.995~3.301 0.052 临床分期 2.483 1.265~4.873 0.008 2.176 1.181~4.011 0.013 淋巴结转移 2.684 1.384~5.206 0.003 2.419 1.240~4.720 0.009 miR-495-3p 2.356 1.205~4.606 0.012 2.219 1.102~4.467 0.025 HJURP 2.439 1.257~4.731 0.008 2.175 1.074~4.405 0.031 miR-495-3p: 微小RNA-495-3p; HJURP: Holliday交叉识别蛋白。 -
[1] 周娟, 马英豪, 赵广利, 等. 2010年-2019年765例甲状腺癌病例特点分析[J]. 中国病案, 2021, 22(3): 79-82. doi: 10.3969/j.issn.1672-2566.2021.03.028 [2] 林晓云, 侯莎莎, 谭建. 微小RNA在甲状腺癌发生、发展中的研究进展[J]. 国际放射医学核医学杂志, 2020, 44(5): 323-327. doi: 10.3760/cma.j.cn121381-201904035-00034 [3] 林钦, 张丽婷, 吴文艺, 等. 特异性核基质结合区结合蛋白1和微小RNA-495-3P在甲状腺乳头状癌侵袭和转移中的作用[J]. 中华实验外科杂志, 2021, 38(1): 139-143. doi: 10.3760/cma.j.cn421213-20200520-01159 [4] 韩听锋, 李春燕, 侯青霞, 等. 微小RNA-495-3p在卵巢癌组织的表达及对卵巢癌细胞凋亡和增殖的影响[J]. 医学研究杂志, 2019, 48(10): 162-166. [5] DING M, JIANG J, YANG F, et al. Holliday junction recognition protein interacts with and specifies the centromeric assembly of CENP-T[J]. J Biol Chem, 2019, 294(3): 968-980. doi: 10.1074/jbc.RA118.004688
[6] YUAN JS, CHEN ZS, WANG K, et al. Holliday junction recognition protein modulates apoptosis, cell cycle arrest and reactive oxygen species stress in human renal cell carcinoma[J]. Oncol Rep, 2020, 44(3): 1246-1254. doi: 10.3892/or.2020.7656
[7] WANG C J, LI X, SHI P, et al. Holliday junction recognition protein promotes pancreatic cancer growth and metastasis via modulation of the MDM2/p53 signaling[J]. Cell Death Dis, 2020, 11(5): 386. doi: 10.1038/s41419-020-2595-9
[8] NAMBRON R, ROSENTHAL R, BAHL D. Diagnosis and evaluation of thyroid nodules-the clinician's perspective[J]. Radiol Clin North Am, 2020, 58(6): 1009-1018. doi: 10.1016/j.rcl.2020.07.007
[9] CORTEZ M A, ANFOSSI S, RAMAPRIYAN R, et al. Role of miRNAs in immune responses and immunotherapy in cancer[J]. Genes Chromosomes Cancer, 2019, 58(4): 244-253. doi: 10.1002/gcc.22725
[10] MONTERO-CONDE C, GRAÑA-CASTRO O, MARTÍN-SERRANO G, et al. Hsa-miR-139-5p is a prognostic thyroid cancer marker involved in HNRNPF-mediated alternative splicing[J]. Int J Cancer, 2020, 146(2): 521-530. doi: 10.1002/ijc.32622
[11] HE Z, DANG J, SONG A, et al. NEAT1 promotes colon cancer progression through sponging miR-495-3p and activating CDK6 in vitro and in vivo[J]. J Cell Physiol, 2019, 234(11): 19582-19591. doi: 10.1002/jcp.28557
[12] CHEN F, LIU L, WANG S. Long non-coding RNA NORAD exhaustion represses prostate cancer progression through inhibiting TRIP13 expression via competitively binding to miR-495-3p[J]. Cancer Cell Int, 2020, 20: 323. doi: 10.1186/s12935-020-01371-z
[13] HORI T, CAO J, NISHIMURA K, et al. Essentiality of CENP-A depends on its binding mode to HJURP[J]. Cell Rep, 2020, 33(7): 108388. doi: 10.1016/j.celrep.2020.108388
[14] WEI Y, OUYANG G L, YAO W X, et al. Knockdown of HJURP inhibits non-small cell lung cancer cell proliferation, migration, and invasion by repressing Wnt/β-catenin signaling[J]. Eur Rev Med Pharmacol Sci, 2019, 23(9): 3847-3856.
[15] SERAFIM R B, CARDOSO C, DI CRISTOFARO L F M, et al. HJURP knockdown disrupts clonogenic capacity and increases radiation-induced cell death of glioblastoma cells[J]. Cancer Gene Ther, 2020, 27(5): 319-329. doi: 10.1038/s41417-019-0103-0
[16] CHEN Y F, LIANG Y X, YANG J A, et al. Upregulation of Holliday junction recognition protein predicts poor prognosis and biochemical recurrence in patients with prostate cancer[J]. Oncol Lett, 2019, 18(6): 6697-6703.
[17] CHEN T, ZHOU L, ZHOU Y, et al. HJURP promotes epithelial-to-mesenchymal transition via upregulating SPHK1 in hepatocellular carcinoma[J]. Int J Biol Sci, 2019, 15(6): 1139-1147. doi: 10.7150/ijbs.30904
-
期刊类型引用(2)
1. 贾淑蔓,王慧慧,李湘汝. LncRNA HULC在乳头状甲状腺癌组织中的表达及意义. 实用癌症杂志. 2024(06): 887-890 .  百度学术
百度学术
2. 郝润梅,刘竟,刘洁,张婷. 长链非编码RNA X染色体失活特异转录物和微小RNA-146-5p在甲状腺癌中的表达及临床意义. 实用临床医药杂志. 2023(05): 72-75+81 .  本站查看
本站查看
其他类型引用(1)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号