Effect of down-regulating lncRNA HOXA-AS3 targeted promotion of miR-29b on the apoptosis of colon cancer cells LOVO and the sensitivity of oxaliplatin
-
摘要:目的 探讨下调长链非编码RNA(lncRNA) HOXA-AS3靶向促进微小RNA-29b(miR-29b)对结肠癌细胞LOVO凋亡和奥沙利铂敏感性的影响。方法 实时聚合酶链反应测定结肠癌细胞LOVO、SW1116、HCT116、SW620和正常结肠上皮细胞NCM460中HOXA-AS3表达变化。结肠癌细胞LOVO分成control组、si-NC组、si-HOXA-AS3组、L-OHP+si-NC组、L-OHP+si-HOXA-AS3组、si-HOXA-AS3 +Anti-miR-NC组、si-HOXA-AS3 +Anti-miR-29b组、L-OHP+ si-HOXA-AS3 +Anti-miR-NC组和L-OHP+si-HOXA-AS3 + Anti-miR-29b组。采用MTT实验、流式细胞术和Western blot分别分析细胞增殖、凋亡以及细胞中Bax、Bcl-2蛋白表达情况。生物学信息学软件预测HOXA-AS3的靶miRNA, 荧光素酶活性测定试剂盒验证HOXA-AS3和miR-29b的靶向关系。结果 与正常结肠上皮细胞NCM460相比,结肠癌细胞LOVO、SW1116、HCT116、SW620中HOXA-AS3表达水平均升高,差异有统计学意义(P < 0.05)。结肠癌细胞LOVO中HOXA-AS3表达水平均高于结肠癌细胞SW1116、HCT116、SW620, 差异有统计学意义(P < 0.05)。与control组、si-NC组比较, si-HOXA-AS3组结肠癌细胞LOVO增殖活性降低,凋亡率升高,细胞中Bax蛋白表达水平升高, Bcl-2蛋白表达减少,差异有统计学意义(P < 0.05)。与si-HOXA-AS3组、L-OHP+si-NC组比较, L-OHP+ si-HOXA-AS3组结肠癌细胞LOVO增殖活性降低,凋亡率升高,细胞中Bax蛋白表达水平升高, Bcl-2蛋白表达减少,差异有统计学意义(P < 0.05)。与si-HOXA-AS3 + Anti-miR-NC组比较, si-HOXA-AS3 +Anti-miR-29b组结肠癌细胞LOVO增殖活性升高,细胞凋亡率降低,细胞中Bax蛋白表达减少, Bcl-2蛋白表达增多,差异有统计学意义(P < 0.05)。与L-OHP+si-HOXA-AS3 + Anti-miR-NC组比较, L-OHP+si-HOXA-AS3 + Anti-miR-29b组结肠癌细胞LOVO增殖活性升高,细胞凋亡率降低,细胞中Bax蛋白表达减少, Bcl-2蛋白表达增多,差异有统计学意义(P < 0.05)。下调HOXA-AS3靶向促进miR-29b表达。结论 下调HOXA-AS3可通过靶向促进miR-29b诱导结肠癌细胞LOVO凋亡并提高奥沙利铂敏感性。
-
关键词:
- 结肠癌 /
- 凋亡 /
- 奥沙利铂 /
- 长链非编码RNA HOXA-AS3 /
- 微小RNA-29b
Abstract:Objective To investigate effect of down-regulating lncRNA HOXA-AS3 targeted promotion of miR-29b on the apoptosis of colon cancer cells LOVO and the sensitivity of oxaliplatin.Methods Real-time polymerase chain reaction was used to detect the changes of HOXA-AS3 expression in colon cancer cells LOVO, SW1116, HCT116, SW620 and normal colon epithelial cells NCM460. Colon cancer cells LOVO were divided into control group, si-NC group, si-HOXA-AS3 group, L-OHP+si-NC group, L-OHP+si-HOXA-AS3 group, si-HOXA-AS3 +Anti-miR-NC group, si-HOXA-AS3 +Anti-miR-29b group, L-OHP+si-HOXA-AS3 +Anti-miR-NC group and L-OHP+si-HOXA-AS3 +Anti-miR-29b group. MTT assay, flow cytometry and Western blot were used to analyze cell proliferation, apoptosis and protein expression of Bax and Bcl-2, respectively. The bioinformatics software predicted the target miRNA of HOXA-AS3, and the luciferase activity assay kit was used to verify the targeting relationship between HOXA-AS3 and miR-29b.Results Compared with normal colonic epithelial cells NCM460, the expression of HOXA-AS3 in colon cancer cells LOVO, SW1116, HCT116 and SW620 were significantly higher (P < 0.05). The expression level of HOXA-AS3 in colon cancer cell LOVO was significantly higher than colon cancer cell SW1116, HCT116 and SW620 (P < 0.05). Compared with the control and si-NC groups, the si-HOXA-AS3 colon cancer cell LOVO proliferation activity decreased, the apoptosis rate increased, the Bax protein expression level in the cells increased, and the Bcl-2 protein expression decreased (P < 0.05). Compared with the si-HOXA-AS3 and L-OHP+si-NC groups, the colon cancer cell LOVO proliferation activity in the L-OHP+si-HOXA-AS3 group decreased, the apoptosis rate increased, and the expression level of Bax protein in the cells increased, the expression of Bcl-2 protein decreased (P < 0.05). Compared with the si-HOXA-AS3 +Anti-miR-NC group, the si-HOXA-AS3 +Anti-miR-29b colon cancer cell LOVO proliferation activity increased, the apoptosis rate decreased, the Bax protein expression in the cells decreased, and Bcl-2 protein expression increased (P < 0.05). Compared with the L-OHP+si-HOXA-AS3 +Anti-miR-NC group, the colon cancer cell LOVO proliferation activity in the L-OHP+si-HOXA-AS3 +Anti-miR-29b group increased, and the apoptosis rate decreased, the expression of Bax protein in cells decreased, and the expression of Bcl-2 protein increased (P < 0.05). Down-regulation of HOXA-AS3 targeted to promote miR-29b expression.Conclusion Down-regulation of HOXA-AS3 targeting promotes miR-29b to induce the apoptosis of colon cancer cells LOVO and increase the sensitivity of oxaliplatin.-
Keywords:
- colon cancer /
- apoptosis /
- oxaliplatin /
- lncRNA HOXA-AS3 /
- miR-29b
-
结肠癌是一种发病率较高的消化系统恶性肿瘤,手术切除、放化疗等是目前临床上常见的治疗手段[1]。奥沙利铂是常见胃肠消化系统恶性肿瘤的治疗药物,具有毒性低和高效的特点[2]。但奥沙利铂对血液、神经等具有一定的毒副作用,这限制了奥沙利铂的长期使用,提高肿瘤细胞奥沙利铂敏感性对于肿瘤的治疗具有重要意义[2]。长链非编码RNA(lncRNA)的转录本长度超过200 nt, 其在真核生物细胞内存在,几乎没有编码蛋白质的作用。lncRNA功能复杂,与染色质修饰、细胞分化、基因组印记、核内运输、热休克反应等有关[3]。lncRNA可以通过类似“miRNA海绵”或“miRNA隔离”作用调控微小RNA(miRNA)的表达[4]。研究[5]发现,lncRNA在肿瘤组织中异常表达, lncRNA不仅影响肿瘤细胞增殖、凋亡,还与肿瘤细胞抗肿瘤药物敏感性有关,lncRNA可能是延长肿瘤患者生存时间的分子靶点。HOXA-AS3是与肿瘤有关的调节因子, HOXA-AS3促进胶质母细胞瘤细胞增殖,加快人肺腺癌细胞迁移,下调HOXA-AS3可增加非小细胞肺癌细胞顺铂敏感性[6-8]。目前HOXA-AS3在结肠癌细胞中的相关研究较少。本研究探讨HOXA-AS3对结肠癌细胞增殖、凋亡和奥沙利铂敏感性的影响及机制,为提高结肠癌患者奥沙利铂敏感性提供参考思路。
1. 材料与方法
1.1 材料
正常结肠上皮细胞NCM460购自弗元(上海)生物科技有限公司; siRNA control、HOXA-AS3 siRNA、miR-29b mimics、mimics control、WT、MUT、inhibitor control、miR-29b inhibitor均由上海吉玛制药技术有限公司构建合成; 结肠癌细胞SW1116、HCT116购自上海瀚杭生物科技有限公司; Bax抗体购自美国Cell Signaling Technology; 结肠癌细胞LOVO购自武汉普诺赛生命科技有限公司; Bcl-2抗体购自美国Santa Cruz Biotechnology; 结肠癌细胞SW620购自上海泽叶生物科技有限公司; 荧光素酶活性测定试剂盒购自美国GeneCopoeia。
1.2 实时聚合酶链反应方法检测HOXA-AS3表达
用Trizol试剂提取结肠癌细胞LOVO、SW1116、HCT116、SW620和正常结肠上皮细胞NCM460中的总RNA, RNA样品经过紫外分光光度计检测OD260 nm/OD280 nm的比值为1.8~2.0, 将RNA保存在-80 ℃。在0.2 mL的PCR管内配制逆转录体系,将聚合酶链反应(PCR)管置于25 ℃孵育5 min, 42 ℃孵育30 min, 85 ℃孵育5 min, 然后放在4 ℃保存。以SYBR Green PCR master mix进行PCR反应,以为GAPDH为内参,根据2-△△Ct法计算HOXA-AS3表达水平。
1.3 细胞转染和分组
利用Lipofectamine 2000在结肠癌细胞LOVO中分别转染siRNA control、HOXA-AS3 siRNA, 记为si-NC组和si-HOXA-AS3组。将转染siRNA control、HOXA-AS3 siRNA以后的结肠癌细胞LOVO分别用含有奥沙利铂浓度为60 μg/mL的细胞培养液培养,记为L-OHP+si-NC组、L-OHP+si-HOXA-AS3组。设置常规培养的结肠癌细胞LOVO为control组。control组、si-NC组、si-HOXA-AS3组细胞培养48 h以后,按照1. 2中实时PCR方法检测HOXA-AS3表达。
1.3.1 四甲基偶氮唑蓝(MTT)实验检测细胞增殖
提前配制5 mg/mL的MTT溶液,过滤除菌后,放在4 ℃备用。将结肠癌细胞LOVO按照1×104个细胞/mL种植到96孔板内,每个孔内添加150 μL的细胞培养液,根据control组、si-NC组、si-HOXA-AS3组、L-OHP+si-NC组、L-OHP+si-HOXA-AS3组的分组方法处理培养,放在37 ℃常规培养48 h以后,在每个孔中添加20 μL的MTT溶液,继续孵育4 h。吸弃孔中的液体,添加150 μL的二甲基亚砜溶液,孵育10 min后,用酶联免疫检测仪分析每个孔的OD值。细胞增殖活性用OD值表示。
1.3.2 流式细胞术检测细胞凋亡
根据control组、si-NC组、si-HOXA-AS3组、L-OHP+si-NC组、L-OHP+si-HOXA-AS3组的分组处理方法处理培养48 h以后,将细胞制备成单细胞悬浮液,每个检测样本含有5×105~1×106个细胞,离心,弃掉上清溶液,继续添加195 μL的Annexin V-FITC结合缓冲液,混合后,添加5 μL的Annexin V-FITC, 室温孵育10 min。离心,弃掉上清,添加190 μL的Annexin V-FITC结合缓冲液,继续加入10 μL的PI, 混合后,放在避光条件下结合10 min。利用流式细胞仪检测凋亡变化。
1.3.3 Western blot方法检测Bax、Bcl-2蛋白表达
根据control组、si-NC组、si-HOXA-AS3组、L-OHP+si-NC组、L-OHP+si-HOXA-AS3组的分组处理方法处理培养48 h以后,吸弃孔中的液体,加入磷酸盐缓冲液(PBS)洗涤2次细胞,继续添加RIPA溶液,超声间断破碎20 min。4 ℃, 12 000 g离心10 min, 将上清溶液转移到EP管中,用BCA方法测定蛋白样品的浓度。在蛋白样品中按照体积比为4∶ 1的比例,添加5×Loading Buffer溶液,沸水浴5 min。选择12 %的下层胶和5 %的上层胶进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)。每个孔内加40 μg的蛋白样品。在上层胶中设置80 V的电压,在分离胶中设置120 V的电压电泳,等到溴酚蓝移动到凝胶的底部位置,结束电泳。裁剪PVDF膜,以100 V的电压转膜2 h。把PVDF膜浸泡在含有5%脱脂奶粉的洗膜缓冲液(TBST)中,室温,摇床80 r/min离心1 h, 以TBST洗涤3次,每次5 min。将PVDF膜放在Bax、Bcl-2、GAPDH(内参)一抗稀释液内, 4 ℃孵育过夜。将PVDF膜置于辣根过氧化物酶标记的二抗中,在室温结合2 h。提前配制好ECL发光试剂,滴加至PVDF膜上,以ChemiDocXRS+显像系统扫描条带,Quantity One分析条带的灰度值,以灰度值根据内参GAPDH分析Bax、Bcl-2蛋白表达水平。Bax、Bcl-2一抗均按照1∶ 1 000稀释,二抗按照1∶ 2 000稀释。
1.4 HOXA-AS3靶基因预测和鉴定
用生物信息学软件starbase分析HOXA-AS3可能的靶miRNA,然后利用荧光素酶报告系统分析二者的靶向关系。在结肠癌细胞LOVO中分别将miR-29b mimics(miR-29b)、mimics control(miR-NC)和WT(含HOXA-AS3结合位点的荧光素酶报告载体)、MUT(含突变以后HOXA-AS3结合位点的荧光素酶报告载体)共转染,继续培养48 h以后,利用荧光素酶活性测定试剂盒分析细胞荧光素酶活性的变化。control组、si-NC组、si-HOXA-AS3组细胞培养48 h以后,按照1.2中实时PCR方法检测miR-29b表达,U6为内参。
1.5 miR-29b inhibitor对下调HOXA-AS3影响细胞增殖、凋亡影响
在结肠癌细胞LOVO中将HOXA-AS3 siRNA、inhibitor control和HOXA-AS3 siRNA、miR-29b inhibitor共转染,记为si-HOXA-AS3 +Anti-miR-NC组和si-HOXA-AS3 +Anti-miR-29b组。同时将共转染HOXA-AS3 siRNA、inhibitor control和HOXA-AS3 siRNA、miR-29b inhibitor后的结肠癌细胞LOVO以给予奥沙利铂浓度为60 μg/mL的细胞培养液培养,命名为L-OHP+si-HOXA-AS3 + Anti-miR-NC组和L-OHP+si-HOXA-AS3 + Anti-miR-29b组。细胞培养48 h以后,根据1.3.1中MTT方法检测细胞增殖,根据1.3.2中流式细胞术检测细胞凋亡,根据1.3.3中Western blot方法检测Bax、Bcl-2蛋白表达。
1.6 统计学分析
利用SPSS 21.0软件分析数据,计量资料用(x±s)表示, 2组数据间比较行t检验,多组差异比较用单因素方差, P < 0.05为差异有统计学意义。
2. 结果
2.1 HOXA-AS3在结肠癌细胞中高表达
与正常结肠上皮细胞NCM460相比(1.00±0.11), 结肠癌细胞LOVO(3.62±0.24)、SW1116(2.51±0.23)、HCT116(2.04±0.13)、SW620(1.69±0.15)中HOXA-AS3表达水平均升高,差异有统计学意义(P < 0.05)。选择表达水平最高的结肠癌细胞LOVO进行后续研究。
2.2 HOXA-AS3 siRNA转染下调结肠癌细胞LOVO中HOXA-AS3表达水平
与control组(1.00±0.12)、si-NC组(0.98±0.09)比较, si-HOXA-AS3组(0.35±0.03)结肠癌细胞LOVO中HOXA-AS3表达水平降低,差异有统计学意义(P < 0.05)。
2.3 下调HOXA-AS3促进奥沙利铂抗结肠癌细胞LOVO增殖和凋亡诱导作用
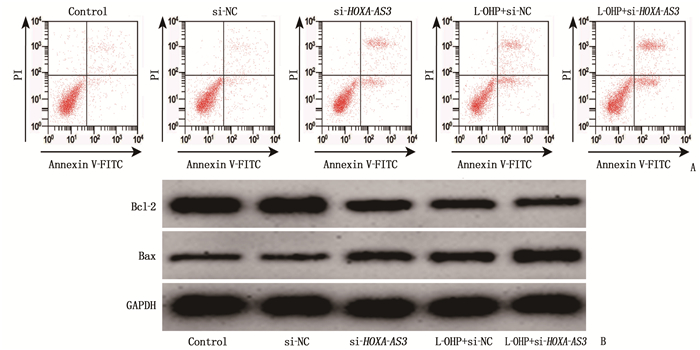
与control组、si-NC组比较, si-HOXA-AS3组结肠癌细胞LOVO增殖活性降低,凋亡率升高,细胞中Bax蛋白表达水平升高, Bcl-2蛋白表达减少。与si-HOXA-AS3组、L-OHP+si-NC组比较, L-OHP+si-HOXA-AS3组结肠癌细胞LOVO增殖活性降低,凋亡率升高,细胞中Bax蛋白表达水平升高, Bcl-2蛋白表达减少。下调HOXA-AS3促进奥沙利铂抗结肠癌细胞LOVO增殖和凋亡诱导作用。见图 1、表 1。
表 1 下调HOXA-AS3和奥沙利铂作用后结肠癌细胞LOVO增殖活性、凋亡率和细胞中Bax、Bcl-2蛋白水平(x±s)组别 增殖活性(OD值) 凋亡率/% Bax Bcl-2 control组 0.69±0.06* 3.95±0.32* 0.23±0.03* 0.85±0.08* si-NC组 0.67±0.05* 3.74±0.42* 0.24±0.04* 0.84±0.06* si-HOXA-AS3组 0.41±0.04# 14.47±1.53# 0.41±0.04# 0.56±0.05# L-OHP+si-NC组 0.38±0.04# 15.82±1.64# 0.45±0.03# 0.47±0.04# L-OHP+si-HOXA-AS3组 0.26±0.03*# 20.01±1.20*# 0.64±0.05*# 0.32±0.03*# 与si-HOXA-AS3组比较, * P < 0.05; 与L-OHP+si-HOXA-AS3组比较, #P < 0.05。 2.4 下调HOXA-AS3靶向促进miR-29b表达
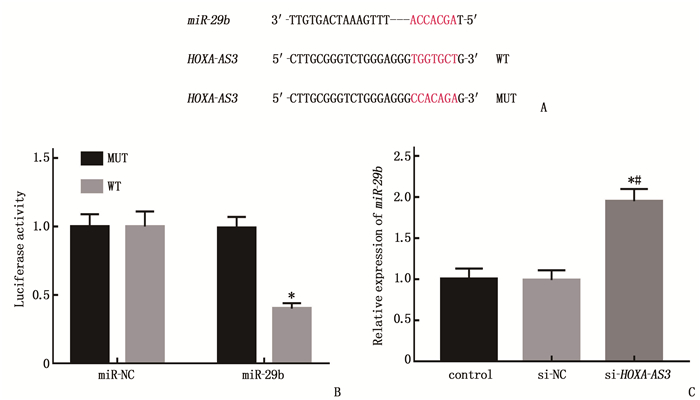
利用生物信息学软件预测得到HOXA-AS3和miR-29b结合位点(图 2A)。荧光素酶报告系统鉴定二者的靶向关系, WT和miR-29b mimics共转染后的结肠癌细胞LOVO荧光素酶活性降低(图 2B)。与control组、si-NC组比较,si-HOXA-AS3组结肠癌细胞LOVO中miR-29b表达水平升高(图 2C)。下调HOXA-AS3靶向促进miR-29b表达。
2.5 miR-29b inhibitor对下调HOXA-AS3影响结肠癌细胞LOVO的作用
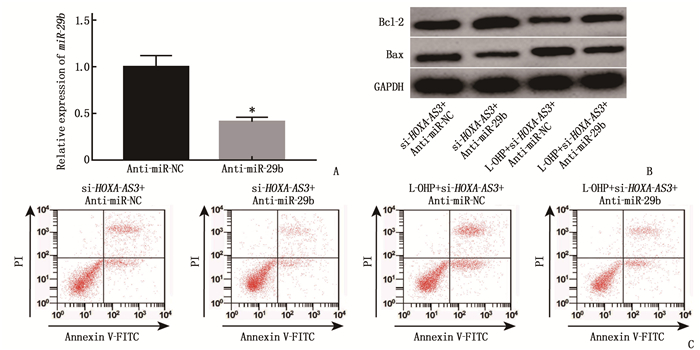
与si-HOXA-AS3 +Anti-miR-NC组比较, si-HOXA-AS3 + Anti-miR-29b组结肠癌细胞LOVO增殖活性升高,细胞凋亡率降低,细胞中Bax蛋白表达减少, Bcl-2蛋白表达增多。与L-OHP+si-HOXA-AS3 +Anti-miR-NC组比较, L-OHP+si-HOXA-AS3 +Anti-miR-29b组结肠癌细胞LOVO增殖活性升高,细胞凋亡率降低,细胞中Bax蛋白表达减少, Bcl-2蛋白表达增多。见图 3、表 2。
表 2 下调HOXA-AS3和奥沙利铂作用后结肠癌细胞LOVO增殖活性、凋亡率和细胞中Bax、Bcl-2蛋白水平(x±s)组别 增殖活性(OD值) 凋亡率/% Bax Bcl-2 si-HOXA-AS3+Anti-miR-NC组 0.40±0.05 13.85±1.63 0.42±0.05 0.54±0.06 si-HOXA-AS3+Anti-miR-29b组 0.52±0.03* 8.51±0.74* 0.23±0.03* 0.83±0.07* L-OHP+si-HOXA-AS3+Anti-miR-NC组 0.27±0.04 21.05±1.64 0.59±0.06 0.35±0.04 L-OHP+si-HOXA-AS3+Anti-miR-29b组 0.39±0.04# 11.47±1.12# 0.38±0.04# 0.45±0.04# 与si-HOXA-AS3 +Anti-miR-NC组比较, * P < 0.05; 与L-OHP+si-HOXA-AS3 +Anti-miR-NC组比较, #P < 0.05。 3. 讨论
近些年来,基因在肿瘤中的作用已经引起人们的广泛重视,其不仅参与调控肿瘤细胞生长,还与肿瘤细胞放化疗敏感性等有关,寻找有效的分子靶点以提高肿瘤患者治疗效果意义重大。lncRNA在多种生物体内表达,并通过调控细胞增殖、凋亡、衰老、分化等过程影响疾病进程,是很多疾病治疗的潜在靶点[9]。肿瘤中lncRNA的表达谱与正常组织和细胞差异较大,而这些差异表达的lncRNA参与影响肿瘤细胞恶性生物学行为的调控过程, lncRNA也逐渐成为分子靶向治疗的热点研究领域[10]。既往研究[11]显示,下调HOXA-AS3, 可降低肺癌细胞A549增殖能力,抑制裸鼠移植瘤生长。本研究发现, HOXA-AS3在结肠癌细胞中的表达水平高于正常结肠细胞,并且下调HOXA-AS3后的结肠癌细胞增殖活性降低,细胞凋亡率升高,细胞中促凋亡蛋白Bax表达水平升高,抗凋亡蛋白Bcl-2表达水平降低,说明HOXA-AS3在结肠癌中可能发挥促进作用,而靶向抑制HOXA-AS3可能是未来结肠癌治疗的途径。
铂类抗肿瘤作用极强,奥沙利铂属于第三代铂类衍生物,其以二氨基环己烷代替了顺铂的2个氨基[12]。铂类药物虽然已经在抗肿瘤领域的应用超过了40年,但是对其具体的抗肿瘤机制还不明确[12]。结肠癌是常见消化系统恶性肿瘤,奥沙利铂在结肠癌治疗中广泛使用。基础研究[13]显示,奥沙利铂能够体外诱导结肠癌细胞凋亡,降低细胞增殖活性。虽然奥沙利铂的毒性小于顺铂,但其对神经系统等有一定的副作用,这使得奥沙利铂不能被长期应用于临床,提高肿瘤患者奥沙利铂敏感性是亟待解决的问题[14]。研究[7]发现, HOXA-AS3能够通过与下游基因相互作用,降低非小细胞肺癌细胞顺铂敏感性。本研究发现, HOXA-AS3 siRNA能够增强奥沙利铂对结肠癌细胞增殖抑制和凋亡促进作用,下调HOXA-AS3进一步加强了奥沙利铂抗结肠癌作用,下调HOXA-AS3可提高结肠癌细胞奥沙利铂敏感性,这对于提高结肠癌患者奥沙利铂敏感性有重要意义。
lncRNA在人体内的作用极为广泛,这与其作用机制有关, lncRNA可通过与miRNA互补结合,影响miRNA的表达,进而调控下游信号通路或进行基因的激活[15-17]。已经发现的HOXA-AS3的下游靶miRNA有多个,如miR-455、miR-29c[6, 18]。利用生物信息学软件和荧光素酶报告系统鉴定HOXA-AS3和miR-29b为靶向关系,并且下调HOXA-AS3靶向促进结肠癌细胞中miR-29b的表达水平,推测HOXA-AS3作用机制可能与miR-29b有关。miR-29b定位在染色体7q32.3, 在很多正常组织中均有表达,与肿瘤的发生和转移有关[19-20]。miR-29b在结肠癌中表达下调,上调miR-29b抑制癌细胞增殖能力,可提高奥沙利铂敏感性[21]。逆转实验显示下调miR-29b可减弱下调HOXA-AS3对结肠癌细胞增殖、凋亡和奥沙利铂敏感性的作用,这进一步提示下调HOXA-AS3可通过靶向促进miR-29b表达抑制结肠癌细胞增殖,诱导细胞凋亡,提高奥沙利铂敏感性,这为研究HOXA-AS3在肿瘤中的作用机制提供了参考依据。
综上所述,下调HOXA-AS3通过靶向促进miR-29b抑制结肠癌细胞增殖,促进细胞凋亡,并提高细胞奥沙利铂敏感性,这对于分子靶向治疗肿瘤和提高肿瘤患者奥沙利铂敏感性具有重要意义。但本研究尚未具体分析HOXA-AS3调控miR-29b的下游机制,这部分内容将在后续研究中进行探讨。
-
表 1 下调HOXA-AS3和奥沙利铂作用后结肠癌细胞LOVO增殖活性、凋亡率和细胞中Bax、Bcl-2蛋白水平(x±s)
组别 增殖活性(OD值) 凋亡率/% Bax Bcl-2 control组 0.69±0.06* 3.95±0.32* 0.23±0.03* 0.85±0.08* si-NC组 0.67±0.05* 3.74±0.42* 0.24±0.04* 0.84±0.06* si-HOXA-AS3组 0.41±0.04# 14.47±1.53# 0.41±0.04# 0.56±0.05# L-OHP+si-NC组 0.38±0.04# 15.82±1.64# 0.45±0.03# 0.47±0.04# L-OHP+si-HOXA-AS3组 0.26±0.03*# 20.01±1.20*# 0.64±0.05*# 0.32±0.03*# 与si-HOXA-AS3组比较, * P < 0.05; 与L-OHP+si-HOXA-AS3组比较, #P < 0.05。 表 2 下调HOXA-AS3和奥沙利铂作用后结肠癌细胞LOVO增殖活性、凋亡率和细胞中Bax、Bcl-2蛋白水平(x±s)
组别 增殖活性(OD值) 凋亡率/% Bax Bcl-2 si-HOXA-AS3+Anti-miR-NC组 0.40±0.05 13.85±1.63 0.42±0.05 0.54±0.06 si-HOXA-AS3+Anti-miR-29b组 0.52±0.03* 8.51±0.74* 0.23±0.03* 0.83±0.07* L-OHP+si-HOXA-AS3+Anti-miR-NC组 0.27±0.04 21.05±1.64 0.59±0.06 0.35±0.04 L-OHP+si-HOXA-AS3+Anti-miR-29b组 0.39±0.04# 11.47±1.12# 0.38±0.04# 0.45±0.04# 与si-HOXA-AS3 +Anti-miR-NC组比较, * P < 0.05; 与L-OHP+si-HOXA-AS3 +Anti-miR-NC组比较, #P < 0.05。 -
[1] RUAN H, LEIBOWITZ B J, ZHANG L, et al. Immunogenic cell death in colon cancer prevention and therapy[J]. Mol Carcinog, 2020, 59(7): 783-793. doi: 10.1002/mc.23183
[2] ARENA S, CORTI G, DURINIKOVA E, et al. A subset of colorectal cancers with cross-sensitivity to olaparib and oxaliplatin[J]. Clin Cancer Res, 2020, 26(6): 1372-1384. doi: 10.1158/1078-0432.CCR-19-2409
[3] WANG W L, LOU W Y, DING B S, et al. A novel mRNA-miRNA-lncRNA competing endogenous RNA triple sub-network associated with prognosis of pancreatic cancer[J]. Aging (Albany NY), 2019, 11(9): 2610-2627.
[4] XU C, ZHAI J, FU Y. LncRNA CDKN2B-AS1 promotes the progression of ovarian cancer by miR-143-3p/SMAD3 axis and predicts a poor prognosis[J]. Neoplasma, 2020, 67(4): 782-793. doi: 10.4149/neo_2020_190617N515
[5] XU Q, LIN Y B, LI L, et al. LncRNA TLR8-AS1 promotes metastasis and chemoresistance of ovarian cancer through enhancing TLR8 mRNA stability[J]. Biochem Biophys Res Commun, 2020, 526(4): 857-864. doi: 10.1016/j.bbrc.2020.03.087
[6] CHEN W H, LI Q Y, ZHANG G L, et al. lncRNA HOXA-AS3 promotes the malignancy of glioblastoma through regulating miR-455-5p/USP3 axis[J]. J Cell Mol Med, 2020, 24(20): 11755-11767. doi: 10.1111/jcmm.15788
[7] LIN S, ZHANG R, AN X X, et al. lncRNA HOXA-AS3 confers cisplatin resistance by interacting with HOXA3 in non-small-cell lung carcinoma cells[J]. Oncogenesis, 2019, 8(11): 60. doi: 10.1038/s41389-019-0170-y
[8] 张超, 曲晓翰, 韩立波. HOXA-AS3通过调控HOXA6/7基因对人肺腺癌细胞增殖凋亡作用机制[J]. 实用医学杂志, 2020, 36(17): 2371-2375. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYZ202017011.htm [9] ZHANG X Y, GUO B, ZHU Y, et al. Up-regulation of plasma lncRNA CACS15 distinguished early-stage oral squamous cell carcinoma patient[J]. Oral Dis, 2020, 26(8): 1619-1624. doi: 10.1111/odi.13245
[10] FAN Y R, SHENG W W, MENG Y, et al. LncRNA PTENP1 inhibits cervical cancer progression by suppressing miR-106b[J]. Artif Cells Nanomed Biotechnol, 2020, 48(1): 393-407. doi: 10.1080/21691401.2019.1709852
[11] ZHANG H Y, LIU Y, YAN L X, et al. Increased levels of the long noncoding RNA, HOXA-AS3 promote proliferation of A549 cells[J]. Cell Death Dis, 2018, 9(6): 707. doi: 10.1038/s41419-018-0725-4
[12] ZHAO Z C, ZHANG G J, LI W D. MT2A promotes oxaliplatin resistance in colorectal cancer cells[J]. Cell Biochem Biophys, 2020, 78(4): 475-482. doi: 10.1007/s12013-020-00930-5
[13] LIU C, LIU Q Q, YAN A W, et al. Metformin revert insulin-induced oxaliplatin resistance by activating mitochondrial apoptosis pathway in human colon cancer HCT116 cells[J]. Cancer Med, 2020, 9(11): 3875-3884. doi: 10.1002/cam4.3029
[14] YAMAZAKI K, YAMANAKA T, SHIOZAWA M, et al. Oxaliplatin-based adjuvant chemotherapy duration (3 versus 6 months) for high-risk stage Ⅱ colon cancer: the randomized phase Ⅲ ACHIEVE-2 trial[J]. Ann Oncol, 2021, 32(1): 77-84. doi: 10.1016/j.annonc.2020.10.480
[15] XU H, CHEN W, ZHENG F, et al. Reconstruction and analysis of the aberrant lncRNA-miRNA-mRNA network in systemic lupus erythematosus[J]. Lupus, 2020, 29(4): 398-406. doi: 10.1177/0961203320908927
[16] 胡珊, 黄奔, 姜扬, 等. 基于lncRNA-miRNA-mRNA调节网络胃癌关键基因筛选与分析[J]. 中华肿瘤防治杂志, 2020, 27(7): 511-518. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202007004.htm [17] PEI Y F, HE Y, HU L Z, et al. The crosstalk between lncRNA-SNHG7/miRNA-181/cbx7 modulates malignant character in lung adenocarcinoma[J]. Am J Pathol, 2020, 190(6): 1343-1354. doi: 10.1016/j.ajpath.2020.02.011
[18] TONG Y X, WANG M S, DAI Y N, et al. lncRNA HOXA-AS3 sponges miR-29c to facilitate cell proliferation, metastasis, and EMT process and activate the MEK/ERK signaling pathway in hepatocellular carcinoma[J]. Hum Gene Ther Clin Dev, 2019, 30(3): 129-141. doi: 10.1089/humc.2018.266
[19] HU S, YAO Y, HU X, et al. LncRNA DCST1-AS1 downregulates miR-29b through methylation in glioblastoma (GBM) to promote cancer cell proliferation[J]. Clin Transl Oncol, 2020, 22(12): 2230-2235. doi: 10.1007/s12094-020-02363-1
[20] YANG X Q, XIN N N, QU H J, et al. Long noncoding RNA TUG1 facilitates cell ovarian cancer progression through targeting miR-29b-3p/MDM2 axis[J]. Anat Rec (Hoboken), 2020, 303(12): 3024-3034. doi: 10.1002/ar.24367
[21] FU Q, ZHANG J D, HUANG G F, et al. microRNA-29b inhibits cell growth and promotes sensitivity to oxaliplatin in colon cancer by targeting FOLR1[J]. Biofactors, 2020, 46(1): 136-145. doi: 10.1002/biof.1579
-
期刊类型引用(2)
1. 郝润梅,刘竟,刘洁,张婷. 长链非编码RNA X染色体失活特异转录物和微小RNA-146-5p在甲状腺癌中的表达及临床意义. 实用临床医药杂志. 2023(05): 72-75+81 .  本站查看
本站查看
2. 陈超,徐俊,李幸,刘畅,熊非. 结肠癌组织中lncRNA HOXA-AS3、miR-29b表达变化及意义. 山东医药. 2023(19): 50-53 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
