Analysis in mutation profile of c-kit and platelet derived growth factor receptor A gene exon and clinicopathological characteristics in gastrointestinal stromal tumors
-
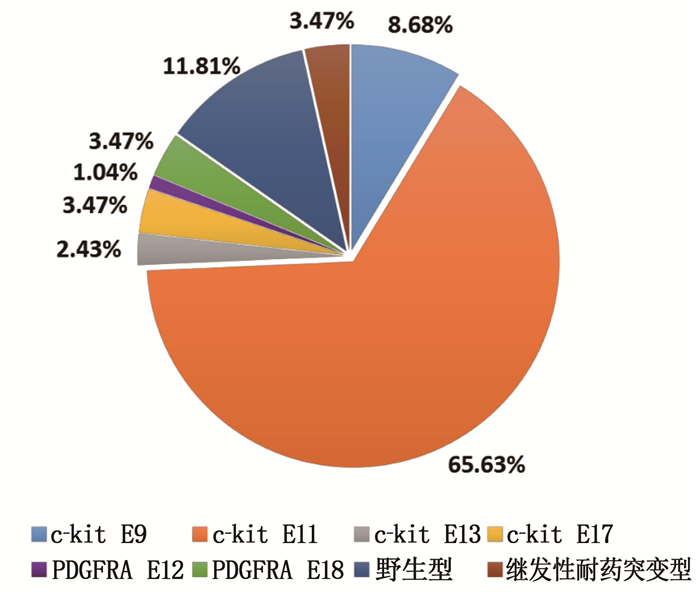
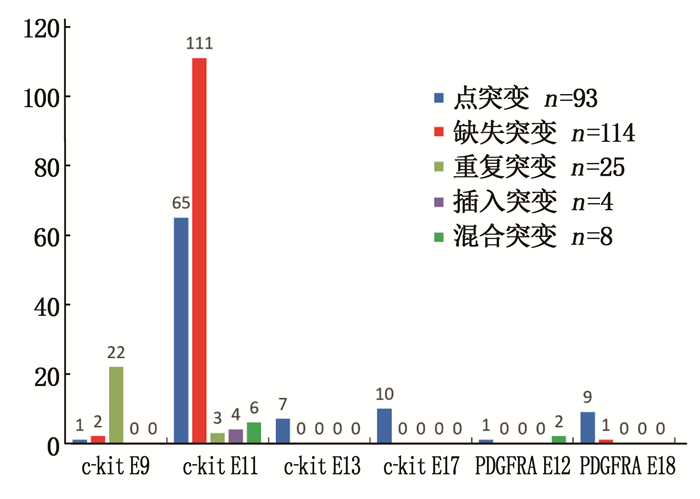
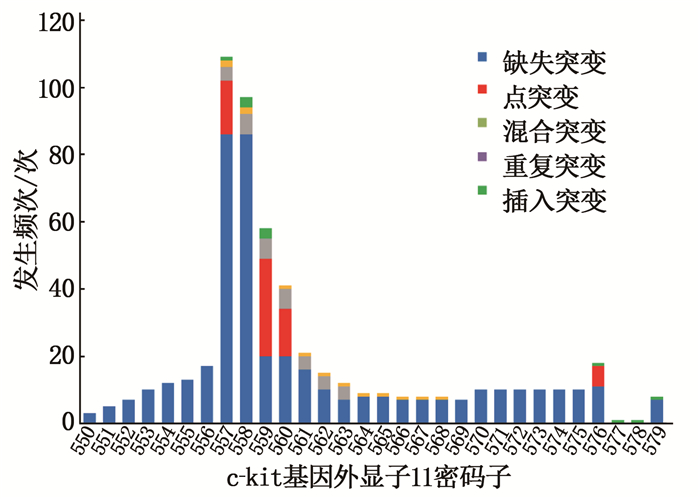
摘要:目的 分析胃肠间质瘤(GIST)中c-kit、血小板源性生长因子受体A(PDGFRA)基因突变类型、特点及其与GIST临床病理学特征的关系。方法 收集288例GIST患者的临床病理资料和肿瘤组织标本,应用聚合酶链式反应扩增-直接测序法检测c-kit(外显子9、11、13、17)与PDGFRA基因(外显子12、18)的突变状态,分析其突变类型、突变位点与临床病理学特征的关系。结果 288例GIST患者中,原发性突变型244例(84.72%),继发性耐药突变型10例(3.47%),野生型34例(11.81%)。244例原发性突变型GIST患者中,c-kit基因突变231例(外显子9、11、13、17突变分别为25、189、7、10例),PDGFRA基因突变13例(外显子12、18突变分别为3、10例)。189例c-kit基因外显子11突变中,缺失突变111例(58.73%)、点突变65例(34.39%)、重复突变3例(1.59%)、插入突变4例(2.12%)、混合突变6例(3.17%);外显子11突变热点区域为557~560位密码子。突变位点与肿瘤原发部位、肿瘤大小、核分裂象计数有关(P < 0.05);突变类型与患者年龄、肿瘤原发部位、肿瘤大小、核分裂像计数、改良美国国立卫生研究院(NIH)危险分级有关(P < 0.05)。Logistic回归分析显示,大于60岁、缺失突变、c-kit外显子11突变的GIST患者,其改良NIH危险分级风险分别增高2.060(95% CI为1.066~3.980)、3.264(95% CI为1.628~6.545)、3.819(95% CI为1.585~9.205)倍。结论 GIST中c-kit和PDGFRA基因突变率高且突变类型位点多样,与GIST患者临床病理及预后密切相关,可为GIST全程化管理提供参考。
-
关键词:
- 胃肠间质瘤 /
- c-kit /
- 血小板源性生长因子受体A /
- 基因突变
Abstract:Objective To analyze the types and characteristics of c-kit and platelet derived growth factor receptor A (PDGFRA) gene mutations in gastrointestinal stromal tumors (GIST) and their relationships with clinicopathological characteristics of GIST.Methods The clinicopathological data and tumor tissue specimens of 288 patients with GIST were collected, and the polymerase chain reaction amplification-direct sequencing method was used to detect the mutation status of c-kit (exons 9, 11, 13, 17) and PDGFRA gene (exons 12, 18), and the relationships between mutation types, sites and clinicopathological characteristics were analyzed.Results Among the 288 GIST cases, 244 cases were primary mutations type (84.72%), 10 cases were secondary drug-resistant mutations type (3.47%), and 34 cases were wild-type (11.81%). Among the 244 patients with primary mutant GIST, there were 231 (94.67%) mutations in the c-kit gene, and the mutations in exons 9, 11, 13, and 17 were 25, 189, 7, and 10 cases, respectively. There were 13 cases with PDGFRA gene mutation, of which exon 12 and 18 mutations were 3 and 10 cases, respectively. Among 189 cases with c-kit gene exon 11 mutations, 111 cases (58.73%) were deletion mutations, 65 cases (34.39%) were point mutations, 3 cases were repeated mutations (1.59%), 4 cases were insertion mutations (2.12%), and 6 cases were mixed mutations (3.17%). The hot spot of exon 11 mutation was codons 557 to 560. The mutation site was related to the primary tumor site, tumor size and mitotic count (P < 0.05). The type of mutation was related to the patient's age, primary site of tumor, tumor size, mitotic count and modified National Institutes of Health (NIH) risk classification (P < 0.05). Logistic regression analysis showed that GIST patients aged more than 60 years old, with deletion mutations and c-kit exon 11 mutations had an increased risk of modified NIH risk classification by 2.060 (95%CI was 1.066 to 3.980), 3.264 (95%CI was 1.628 to 6.545) and 3.819 (95%CI was 1.585 to 9.205) times.Conclusion The c-kit and PDGFRA genes in GIST have a high mutation rate and diverse mutation types or sites, which are closely related to the clinicopathology and prognosis of GIST patients, and can provide a reference for the whole-process management of GIST. -
干燥综合征(SS)是一种常见的进展缓慢的系统性自身免疫性疾病,可以单独发生,被称为原发性干燥综合征(pSS), 也可以继发于其他自身免疫性疾病,被称为继发性干燥综合征(sSS)。pSS的特征是淋巴细胞浸润、唾液腺和泪腺功能丧失、口干、眼干、乏力和关节痛等症状,严重者影响生活质量[1]。高达40%的pSS患者会出现全身性损害,如间质性肺病等[1]。B细胞在pSS发病机制中的作用已得到证实,固有免疫及适应性免疫中的体液免疫、细胞免疫均参与了该病的发生发展[2]。2019年欧洲抗风湿病联盟(EULAR)制定了首个基于证据和共识的pSS患者局部和全身药物治疗建议,其中提到对于患有严重难治性全身疾病的pSS患者可考虑采用B细胞靶向疗法[3], 同时针对B细胞的许多新疗法正在临床试验中。本文对生物改善病情抗风湿药(DMARDs)调节B细胞治疗pSS患者的相关研究及未来治疗方向进行综述和展望。
1. B细胞在pSS发病中的作用
pSS的病理生理学改变主要为小唾液腺内淋巴细胞浸润,这种细胞浸润以T、B淋巴细胞为主,只有约10%的巨噬细胞和树突状细胞浸润[4], 在这些细胞中, B细胞在pSS的发病中起中心作用。
1.1 B细胞活化的驱动因素
B细胞活化是pSS的一个主要特征,但B细胞活化在pSS中的驱动因素目前尚不清楚。一项研究[5]结果显示,边缘区(MZ)周围的中性粒细胞通过产生B细胞活化因子(BAFF)、B细胞表达增殖诱导配体(APRIL)和白细胞介素(IL)-21促进B细胞的分化和活化。B细胞亚群中, CD27-原始B细胞比例增加、CD27+记忆性B细胞比例减少[6]、边缘区B细胞活化、IL-10+和IL-35+调节性B细胞功能缺陷也是参与B细胞活化的关键因素[7]。此外, Toll样受体(TLR)介导的信号转导通路也是B细胞活化的重要途径[8]。
1.2 BAFF
1.2.1 BAFF激活B细胞
在pSS患者血清中BAFF的浓度明显增加,同时唾液腺组织中上皮细胞、B细胞、T细胞等均可以分泌表达BAFF[9]。BAFF是调节免疫反应的肿瘤坏死因子(TNF)超家族成员,能够促进B细胞的存活、成熟和分化。BAFF由多种细胞产生,包括抗原提呈细胞、中性粒细胞、上皮细胞和活化的T细胞[10]。BAFF是一种Ⅱ型膜结合蛋白,C末端可以从细胞中释放出来,以可溶性蛋白的形式表达,并与其受体跨膜激活剂和钙调节亲环素配体(TACI)、B细胞成熟抗原(BCMA)和B细胞活化因子受体(BR3或BAFF-R)结合。其中, BAFF与TACI结合可调节抗体的产生,而BAFF与BCMA结合能促进B细胞的存活、成熟和分化, BR3可表达于B细胞、活化的T细胞和树突状细胞上,在B细胞的成熟中起重要作用[11]。
1.2.2 BAFF与pSS的相关研究
GROOM J等[12]首先证实了BAFF与pSS的关系, BAFF过表达的小鼠出现了类似于pSS的病理生理表现,如唾液腺炎及唾液分泌减少,下颌下腺破坏及炎症等,提示BAFF过表达与pSS发病相关。随后MARIETTE X等[13]研究发现抗Ro/SSA抗体、抗La/SSB抗体阳性及类风湿因子(RF)水平升高的pSS患者,其血清BAFF水平显著升高,提示BAFF可能在激活特异性自身反应性B细胞及调节自身抗体产生方面发挥作用。pSS患者的唾液腺中也检测到BAFF水平较高[14]。YOSHIMOTO K等[15]研究发现, pSS患者外周血单核细胞上BR3表达升高与患者血清免疫球蛋白(Ig)G、IgM水平及干燥综合征疾病活动指数(ESSDAI)评分呈正相关。pSS患者血清中BAFF水平显著增加,同时唾液腺上皮细胞、B细胞等也可分泌表达BAFF[9, 14]。此外,有淋巴瘤或淋巴结前病变的pSS患者血清BAFF水平较无淋巴瘤或淋巴结前病变的pSS患者升高,且与ESSDAI评分显著相关。唾液腺中克隆性B细胞的扩增与较高的血清BAFF水平相关,但主要为单克隆性扩增[16]。这提示BAFF水平增高和组织单克隆性B细胞增殖是pSS合并有B细胞淋巴瘤患者的特征。
2. B细胞靶向治疗pSS的临床试验
2.1 CD20
利妥昔单抗(RTX)是一种针对B细胞及其前体的CD20细胞表面标记的人-鼠嵌合单克隆抗体,可直接靶向并清除B淋巴细胞,现已作为一种既定有效的生物疗法治疗一些自身免疫性疾病。但是RTX在治疗pSS中的作用仍有待确定,对于其疗效仍存在争议。早期的小型随机对照试验显示其有治疗效果[17-18]。2010年发表的一项RCT报告称, RTX治疗显著改善了非刺激性全唾液腺流率(UWS)和其他几个变量,包括B细胞和RF因子水平、干燥症状的视觉模拟评分法(VAS)评分和泪腺功能[18], 而且RTX对泪腺功能的影响也在其他研究[19]中观察到。对以全身受累的患者为重点的研究[20]表明, RTX有良好的疗效和安全性,尤其是紫癜、冷球蛋白血症诱发血管炎或者有持续或复发性腮腺肿大的患者[21]。还有一些研究显示RTX可以改善患者疲劳、疼痛症状以及提高生活质量。然而,一项包括120例患者的较大规模临床试验发现, RTX和安慰剂治疗的患者之间没有明显差异, RTX既不能降低ESSDAI评分,也不能减少关节受累或腮腺肿胀,尽管研究者在早期(研究至6周时)观察到针对疲劳有改善效果[22]。因此,虽然RTX不能作为pSS的一般常规治疗,但其可能对pSS患者的特定的、尚未确定的亚组有效[23]。研究[24]表明pSS患者对RTX的不同反应与治疗前BAFF水平和随后B细胞活化相关,这表明血液或唾液腺B细胞相关生物标记物在pSS患者靶向B细胞治疗中的个性化应用,可能是未来需要研究的方向。
2.2 BAFF
目前针对BAFF(贝利尤单抗)和BAFF受体BR3(Ianalumab, VAY736)的药物已经进行了临床试验。
2.2.1 贝利尤单抗
贝利尤单抗是一个靶向BAFF的全人源化的抗BAFF单克隆抗体,通过结合可溶性BAFF, 阻断B淋巴细胞分化未浆细胞,促使B淋巴细胞凋亡,抑制B淋巴细胞的存活,现已被证实对系统性红斑狼疮(SLE)有较好的治疗作用,并已应用于临床。BELISS是一项评估贝利尤单抗在pSS患者中疗效及安全性的开放性Ⅱ期试验,该试验共纳入了30例pSS患者,在28周时进行评估,评估依据是以下5项疾病指标(干燥、疼痛、疲劳、ESSDAI测量的全身性病症活动度和B细胞生物标志物)中至少有2项获得改善,结果为60%的患者达到了主要终点,但唾液流量或泪液分泌(Schirmer试验)均未有显著改善[25]。随后对其中13例患者进行随访,结果发现,血清中的RF和BAFF水平在停药12个月后明显升高,提示贝利尤单抗靶向BAFF治疗pSS有效,并能够抑制RF阳性B细胞的增殖[26]。但对于该药仍需要更大样本量、更长疗程的临床随机对照研究来证实其在pSS患者中的治疗作用。
2.2.2 VAY376
VAY376是一种清除B细胞、阻断BAFF受体的人IgG1/κ单克隆抗体。目前,一项评估VAY736疗效的双盲、安慰剂对照Ⅱ期单中心研究发现, VAS和36项健康调查(SF-36)评分有所改善,提示VAY736可以持续耗竭B细胞,从而为pSS患者提供治疗,同时该治疗有可能长期改善疾病进展,因此VAY736在pSS的治疗中具有前景,但可能需要更多的数据支持,目前对pSS患者正在进行更大的Ⅱ期研究[27](NCT 02962895)。
2.3 依帕珠单抗(CD22)
CD22是一种在大多数成熟B细胞上表达的Ⅰ型跨膜蛋白,是B细胞受体(BCR)的抑制性辅助受体。依帕珠单抗是一种直接靶向并调节B淋巴细胞功能的抗CD22受体的人源化IgG1κ单克隆抗体,其与CD22结合并增强CD22磷酸化,导致BCR复合物从细胞表面移除,下调BCR下游信号的活性,从而抑制B细胞的功能[28]。在一项pSS的小型开放性Ⅱ期试验研究[29]中, 16例患者接受了4个月的依帕珠单抗治疗,结果显示53%的患者获得了满意的临床疗效,疲劳、VAS评分、Schirmer试验、UWS和医生的总体评估都有显著改善。最近一项针对SLE相关SS患者的研究[30]发现,使用依帕珠单抗治疗可改善SLE相关SS患者的疾病活动度,同时B细胞数量、IgM水平和抗SSA水平持续降低,这在没有SLE相关的SS患者中没有观察到。但是对于该药物在pSS患者中的应用,还需进行随机试验验证。
3. pSS的治疗前景展望
目前对pSS的治疗主要集中在免疫调节方面,而不是恢复唾液腺功能。针对唾液腺功能丧失的局部治疗方法的研究已取得一定的效果。
3.1 水通道蛋白
使用重组腺病毒作为基因载体,传递水通道蛋白(AQP)1恢复唾液腺的膜通透性被证实安全有效,可使一些放射性口干症患者的唾液流量持续增加[31]。在SS小鼠模型的唾液腺中表达AQP1, 恢复了膜通透性,并且降低了疾病相关的IL-1β和TNF-α等多种促炎细胞因子和部分趋化因子的水平,提示使用AQP改善pSS患者唾液腺缺陷的可能性[32]。
3.2 SMAD蛋白调节
研究[32-33]表明,骨形态发生蛋白6(BMP6)在pSS患者的唾液腺中过度表达,与唾液腺功能下降有关。BMP6信号通过Ⅰ型受体,导致SMAD1/5/8磷酸化,最终改变细胞核内的基因表达。BMP6的受体存在于唾液腺的导管细胞、腺泡细胞以及许多免疫细胞上,提示BMP6可能是调节腺体活动和细胞免疫的一个干预点。研究[34]表明pSS的发病机制可能与唾液腺来源的间充质干细胞(SGMSCs)功能受损有关。体外研究[34]表明, BMP6可通过DNA结合蛋白抑制剂-1下调前列腺素E2合酶,从而影响正常SGMSCs的免疫调节功能。小分子对SMAD磷酸化的调节可使液体运动恢复。目前,有针对BMP受体抑制剂LDN-212854和LDN-193189的研究,用LDN-212854或LDN-193189处理BMP6过表达小鼠或C57BL/6. NOD-Aec1Aec2小鼠,阻断了BMP6诱导的SMAD1/5/8磷酸化,并随着AQP5表达的增加而降低DNA结合蛋白3抑制因子ID3(pSMAD1/5/8应答基因)的表达,治疗虽没有改变淋巴细胞浸润面积的大小,但减少了小鼠颌下腺中Th1细胞的相对数量[35]。
3.3 BCR信号传导
Bruton's酪氨酸激酶(BTK)是B细胞生存、增殖和分化所必需的。BTK蛋白在体外活化的B细胞中表达上调,并与BTK磷酸化相关。研究[36]发现,大部分pSS患者外周血BTK蛋白表达增加,并且pSS患者B细胞中BTK表达水平与血清自身抗体及唾液腺T细胞浸润相关。目前,用于治疗B细胞恶性肿瘤的BTK抑制剂tirabrutinib (ONO-4059/GS-4059)也被考虑用于治疗SS患者(NCT03100942)[37]。
磷脂酰肌醇3激酶(PI3K)信号在B细胞发育过程中起关键作用,参与BCR下游成熟B细胞的信号传导。PI3Kδ在B细胞增殖、迁移中起重要作用,并已成功用于B细胞恶性肿瘤的靶向治疗。NAYAR S等[38]在模仿pSS某些特征的局灶性唾液腺炎小鼠模型中,使用选择性PI3Kδ抑制剂seletalisib(UCB5857)后,减少了小鼠腺体内淋巴细胞和浆细胞的蓄积,且显著减少了与异位淋巴细胞生成有关的趋化因子、细胞因子以及自身抗体的产生,同时显著改善了小鼠的唾液流量,该结果证实PI3Kδ活性在pSS发病机制中的作用,为下一步pSS患者的临床试验的进行与评估提供了依据。
3.4 上皮细胞
pSS患者唾液腺功能中其他关键通道的失调可导致腺体功能丧失。囊性纤维化跨膜转导调节因子(CFTR)是导管液分泌的重要通道,在SS小鼠模型[39]中,导管氯离子通道的CFTR的表达显著降低。用小分子药物(C18、VX770)治疗小鼠,改善CFTR的活性或运输,恢复唾液腺活性,减少组织炎症和纤维化,并增加其他功能,包括钙信号转导和腺泡细胞中AQP5的表达。在临床试验开始之前,有必要进行相关研究评估该药物在pSS患者中的应用效果。
3.5 Ly9
Ly9是细胞表面受体的淋巴细胞活化分子(SLAM)家族成员,存在于B细胞和T淋巴细胞上,在自然杀伤T细胞和边缘区B细胞上高表达[40]。在同时表现腺体和腺外炎症特征的NOD. H-2h4小鼠模型中[41], 研究者发现激活Ly9可改善唾液腺炎症和减少自身抗体产生,这提示pSS的潜在治疗策略。
4. 总结
综上所述, B细胞活化在pSS患者发病机制中具有重要作用。近年来,针对pSS的药物治疗试验较少。由于pSS相关临床表型的异质性和复杂的潜在分子发病机制,pSS进行的小型随机对照试验中经常获得阴性结果。因此,今后应对pSS患者亚组进行仔细选择和鉴定,以达到最优疗效,同时减少副作用,此外仍需要进行更多研究以获得更安全有效的治疗方法。
-
表 1 c-kit和PDGFRA外显子的PCR引物
外显子 正向引物 反向引物 c-kit基因 外显子9 GCCACATCCCAAGTGTTTTATG GAGCCTAAACATCCCCTTAAATTG 外显子11 CCAGAGTGCTCTAATGACTG TTATGTGTACCCAAAAAGGTGACA 外显子13 GCTTGACATCAGTTTGCCAG GACAGACAATAAAAGGCAGCTTG 外显子17 TACAAGTTAAAATGAATTTAAATGGT AAGTTGAAACTAAAAATCCTTTGC PDGFRA基因 外显子12 CTCTGGTGCACTGGGACTTT GCAAGGGAAAAGGGAGTCTT 外显子18 CTTGCAGGGGTGATGCTATT AGAAGCAACACCTGACTTTAGAGATTA 表 2 244例原发性MUT-GIST患者临床病理学特征
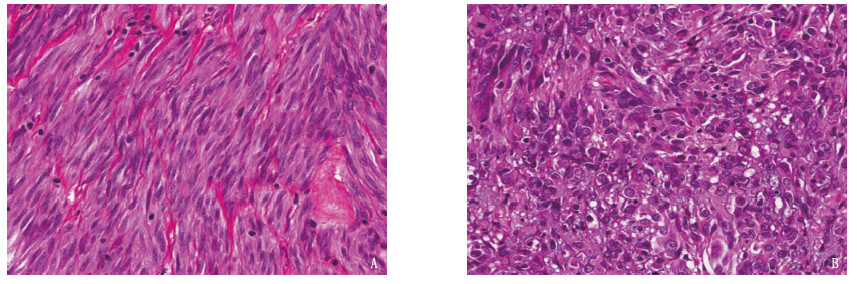
特征 n 占比/% 性别 男 144 59.02 女 100 40.98 年龄 ≤60岁 128 52.46 > 60岁 116 47.54 临床表现 腹痛 104 42.62 消化道出血 70 28.69 梗阻 17 6.97 穿孔/破裂 9 3.69 体质量下降 6 2.46 无症状 38 15.57 肿瘤原发部位 胃 162 66.39 十二指肠 8 3.28 小肠 35 14.34 结肠 3 1.23 直肠 17 6.97 胃肠道外 19 7.79 肿瘤最大径 ≤5 cm 77 31.56 > 5~10 cm 114 46.72 > 10 cm 53 21.72 细胞分型 梭形细胞型 187 76.64 上皮细胞型 45 18.44 混合细胞型 12 4.92 核分裂象计数 0~5个/50 HPFs 153 62.70 > 5~10个/50 HPFs 77 31.56 > 10个/50 HPFs 14 5.74 肿瘤破裂 是 5 2.05 否 239 97.95 改良NIH危险分级 极低危 9 3.69 低危 47 19.26 中危 67 27.46 高危 121 49.59 CD117 - 7 2.87 + 222 90.98 
9 3.69 
6 2.46 DOG-1 - 15 6.15 + 223 91.39 
5 2.05 
1 0.41 CD34 - 18 7.38 + 215 88.11 
0 0 
11 4.51 HPFs: 高倍镜视野; NIH: 美国国立卫生研究院。 表 3 244例原发性MUT-GIST外显子突变类型比较
突变类型 c-kit外显子 PDGFRA外显子 E9 E11 E13 E17 E12 E18 点突变 1 65 7 10 1 9 缺失突变 2 111 0 0 0 1 重复突变 22 3 0 0 0 0 插入突变 0 4 0 0 0 0 混合突变 0 6 0 0 2 0 表 4 c-kit外显子11密码子突变频次
密码子 突变类型 合计 占比/% 插入突变 点突变 混合突变 缺失突变 重复突变 550 0 0 0 3 0 3 0.54 551 0 0 0 5 0 5 0.90 552 0 0 0 7 0 7 1.26 553 0 0 0 10 0 10 1.80 554 0 0 0 12 0 12 2.15 555 0 0 0 13 0 13 2.33 556 0 0 0 17 0 17 3.05 557 1 16 4 86 2 109 19.57 558 3 0 6 86 2 97 17.41 559 3 29 6 20 0 58 10.41 560 0 14 6 20 1 41 7.36 561 0 0 4 16 1 21 3.77 562 0 0 4 10 1 15 2.69 563 0 0 4 7 1 12 2.15 564 0 0 0 8 1 9 1.62 565 0 0 0 8 1 9 1.62 566 0 0 0 7 1 8 1.44 567 0 0 0 7 1 8 1.44 568 0 0 0 7 1 8 1.44 569 0 0 0 7 0 7 1.26 570 0 0 0 10 0 10 1.80 571 0 0 0 10 0 10 1.80 572 0 0 0 10 0 10 1.80 573 0 0 0 10 0 10 1.80 574 0 0 0 10 0 10 1.80 575 0 0 0 10 0 10 1.80 576 1 6 0 11 0 18 3.23 577 1 0 0 0 0 1 0.18 578 1 0 0 0 0 1 0.18 579 1 0 0 7 0 8 1.44 合计 11 65 34 434 13 557 100.00 表 5 10例继发性耐药MUT-GIST患者的临床病理及基因突变信息
序号 性别 年龄 原发部位 肿瘤最大径 细胞分型 核分裂象计数 转移、复发部位 原发性突变 继发性突变 时间间隔 1 男 63 胃 4.0 cm 梭形细胞型 0~5个/50 HPFs 胃 c-kit E11 del D579 c-kit E18 F848V 20个月 2 男 54 胃 10.2 cm 梭形细胞型 0~5个/50 HPFs 肝、腹壁 c-kit E11 del K558-E562 c-kit E13 V654A 47个月 3 女 60 胃 10.0 cm 梭形细胞型 5~10个/50 HPFs 腹腔、盆腔 c-kit E11 del W557-K558 c-kit E18 L862L 18个月 4 女 55 胃 6.5 cm 梭形细胞型 0~5个/50 HPFs 腹腔、盆腔 c-kit E11 V560D c-kit E18 L862L 21个月 5 女 54 胃 14.0 cm 混合细胞型 > 5~10个/50 HPFs 肝、腹腔、盆腔 c-kit E11 del W557-K558 c-kit E18 L862L 12个月 6 男 53 胃 20.0 cm 梭形细胞型 > 5~10个/50 HPFs 胃、横结肠 c-kit E11 del W557-K558 c-kit E18 A829P 32个月 7 男 57 胃 7.5 cm 梭形细胞型 0~5个/50 HPFs 腹腔、盆腔 c-kit E11 L576P c-kit E18 L862L 18个月 8 男 62 胃 4.5 cm 梭形细胞型 0~5个/50 HPFs 胃 c-kit E11 V559D c-kit E13 V654A 46个月 9 女 67 胃 5.0 cm 梭形细胞型 0~5个/50 HPFs 胃 c-kit E11 V557R c-kit E17 N822K 13个月 10 男 51 小肠 10.0 cm 梭形细胞型 0~5个/50 HPFs 肝、盆腔 c-kit E9 A502_Y503dup c-kit E17 D820Y 28个月 HPFs: 高倍镜视野; 时间间隔: 继发性突变发生距原发性突变发生的间隔时间 表 6 244例原发性MUT-GIST患者基因突变位点与临床病理特征的关系
特征 c-kit外显子 PDGFRA外显子 χ2/F P E9 E11 E13 E17 E12 E18 性别 男 14 112 5 6 2 5 0.957 0.973 女 11 77 2 4 1 5 年龄 ≤60岁 17 94 3 6 2 6 3.941 0.585 > 60岁 8 95 4 4 1 4 原发部位 胃 8 133 6 6 2 7 73.826 0.001 十二指肠 0 7 1 0 0 0 小肠 15 20 0 0 0 0 结肠 0 2 0 0 0 1 直肠 1 12 0 1 1 2 胃肠道外 1 15 0 3 0 0 肿瘤最大径 ≤5 cm 2 67 1 3 2 2 20.250 0.019 > 5~10 cm 21 77 5 5 1 5 > 10 cm 2 45 1 2 0 3 细胞分型 梭形细胞型 16 151 4 7 3 6 12.044 0.182 上皮细胞型 6 31 3 2 0 3 混合细胞型 3 7 0 1 0 1 核分裂象计数 0~5个/50 HPFs 5 128 2 8 3 7 31.097 0.001 > 5~10个/50 HPFs 14 53 5 2 0 3 > 10个/50 HPFs 6 8 0 0 0 0 改良NIH危险分级 极低危 0 8 0 1 0 0 19.855 0.096 低危 2 40 0 2 2 1 中危 4 51 5 2 1 4 高危 19 90 2 5 0 5 CD117 阴性 2 4 0 1 0 0 6.309 0.275 阳性 23 185 7 9 3 10 DOG-1 阴性 3 9 0 3 0 0 9.281 0.061 阳性 22 180 7 7 3 10 CD34 阴性 0 16 2 0 0 0 6.261 0.184 阳性 25 173 5 10 3 10 HPFs: 高倍镜视野; NIH: 美国国立卫生研究院。 表 7 244例原发性MUT-GIST患者基因突变类型与临床病理特征的关系
特征 突变类型 χ2/F P 点突变 缺失突变 重复突变 插入突变 混合突变 性别 男 49 72 16 2 5 2.780 0.595 女 44 42 9 2 3 年龄 ≤60岁 61 47 15 1 4 13.995 0.007 > 60岁 32 67 10 3 4 原发部位 胃 73 72 8 3 6 55.351 0.001 十二指肠 1 6 0 0 1 小肠 7 13 14 1 0 结肠 1 2 0 0 0 直肠 7 7 2 0 1 胃肠道外 4 14 1 0 0 肿瘤最大径 ≤5 cm 37 32 2 3 3 27.685 0.002 > 5~10 cm 43 45 20 1 5 > 10 cm 13 37 3 0 0 细胞分型 梭形细胞型 71 91 16 4 5 7.732 0.380 上皮细胞型 19 16 7 0 3 混合细胞型 3 7 2 0 0 核分裂象计数 0~5个/50 HPFs 72 66 6 4 5 32.363 0.001 > 5~10个/50 HPFs 20 41 14 0 2 > 10个/50 HPFs 1 7 5 0 1 NIH危险分级 极低危 5 4 0 0 0 27.676 0.003 低危 27 13 2 3 2 中危 28 30 5 1 3 高危 33 67 18 0 3 CD117 阴性 3 2 2 0 0 3.755 0.451 阳性 90 112 23 4 8 DOG-1 阴性 5 9 1 0 0 0.871 0.880 阳性 88 105 24 4 8 CD34 阴性 7 9 1 0 1 1.208 0.859 阳性 86 105 24 4 7 HPFs: 高倍镜视野; NIH: 美国国立卫生研究院。 表 8 GIST危险分级的Logistic回归分析
因素 OR 95%CI P 年龄 ≤60岁 1.000 - 0.032 > 60岁 2.060 1.066~3.980 突变类型 其他突变 1.000 - 0.001 缺失突变 3.264 1.628~6.545 外显子 其他外显子 1.000 - 0.003 c-kit外显子11 3.819 1.585~9.205 -
[1] FLETCHER C D M, BRIDGE J A, HOGENDOORN P C W, et al. WHO classification of tumours of soft tissue and bone[M]. 4th Edition. Lyon: IARC Press, 2013: 164-167.
[2] 中国临床肿瘤学会胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识(2017年版)[J]. 肿瘤综合治疗电子杂志, 2018, 4(1): 31-43. doi: 10.3969/j.issn.2095-5324.2018.01.007 [3] VON MEHREN M, JOENSUU H. Gastrointestinal stromal tumors[J]. J Clin Oncol, 2018, 36(2): 136-143. doi: 10.1200/JCO.2017.74.9705
[4] WANG M, XU J, ZHAO W, et al. Prognostic value of mutational characteristics in gastrointestinal stromal tumors: a single-center experience in 275 cases[J]. Med Oncol, 2014, 31(1): 819. doi: 10.1007/s12032-013-0819-x
[5] DOYLE L A, HORNICK J L. Gastrointestinal stromal tumours: from KIT to succinate dehydrogenase[J]. Histopathology, 2014, 64(1): 53-67. doi: 10.1111/his.12302
[6] HEINRICH M C, CORLESS C L, DUENSING A, et al. PDGFRA activating mutations in gastrointestinal stromal tumors[J]. Science, 2003, 299(5607): 708-710. doi: 10.1126/science.1079666
[7] SZUCS Z, THWAY K, FISHER C, et al. Molecular subtypes of gastrointestinal stromal tumors and their prognostic and therapeutic implications[J]. Future Oncol Lond Engl, 2017, 13(1): 93-107. doi: 10.2217/fon-2016-0192
[8] 李艳艳, 高静, 田野, 等. 827例胃肠间质瘤c-kit或PDGFRα基因突变谱解读及其与临床病理特征的关系[J]. 中华胃肠外科杂志, 2015, 18(4): 332-337. doi: 10.3760/cma.j.issn.1671-0274.2015.04.009 [9] GOUNDER M M, MAKI R G. Molecular basis for primary and secondary tyrosine kinase inhibitor resistance in gastrointestinal stromal tumor[J]. Cancer Chemother Pharmacol, 2011, 67(1): 25-43. http://europepmc.org/articles/PMC3275340/
[10] HEINRICH M C, CORLESS C L, DEMETRI G D, et al. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor[J]. J Clin Oncol, 2003, 21(23): 4342-4349. doi: 10.1200/JCO.2003.04.190
[11] BARTHOLOMEW A J, DOHNALEK H, PRINS P A, et al. Underuse of exon mutational analysis for gastrointestinal stromal tumors[J]. J Surg Res, 2018, 231: 43-48. doi: 10.1016/j.jss.2018.05.014
[12] 陶凯雄, 张鹏. 胃肠间质瘤全程化管理[J]. 腹部外科, 2020, 33(1): 9-13. doi: 10.3969/j.issn.1003-5591.2020.01.003 [13] ANDERSSON J, BÜMMING P, MEIS-KINDBLOM J M, et al. Gastrointestinal stromal tumors with KIT exon 11 deletions are associated with poor prognosis[J]. Gastroenterology, 2006, 130(6): 1573-1581. doi: 10.1053/j.gastro.2006.01.043
[14] 孙祥飞, 高晓东, 袁伟, 等. 59例血小板源性生长因子受体α突变型胃肠间质瘤的临床病理特征和预后分析[J]. 中华胃肠外科杂志, 2020, 23(9): 880-887. doi: 10.3760/cma.j.cn.441530-20200320-00156 [15] DUENSING S, DUENSING A. Targeted therapies of gastrointestinal stromal tumors (GIST): the next frontiers[J]. Biochem Pharmacol, 2010, 80(5): 575-583. doi: 10.1016/j.bcp.2010.04.006
[16] 孙祥飞, 高晓东, 沈坤堂. 胃肠间质瘤中伊马替尼继发性耐药机制的研究进展[J]. 中华胃肠外科杂志, 2019, 22(9): 886-890. [17] WARDELMANN E, MERKELBACH-BRUSE S, PAULS K, et al. Polyclonal evolution of multiple secondary KIT mutations in gastrointestinal stromal tumors under treatment with imatinib mesylate[J]. Clin Cancer Res, 2006, 12(6): 1743-1749. doi: 10.1158/1078-0432.CCR-05-1211
[18] GRAMZA A W, CORLESS C L, HEINRICH M C. Resistance to tyrosine kinase inhibitors in gastrointestinal stromal tumors[J]. Clin Cancer Res, 2009, 15(24): 7510-7518. doi: 10.1158/1078-0432.CCR-09-0190
[19] KALFUSOVA A, LINKE Z, KALINOVA M, et al. Gastrointestinal stromal tumors-Summary of mutational status of the primary/secondary KIT/PDGFRA mutations, BRAF mutations and SDH defects[J]. Pathol Res Pract, 2019, 215(12): 152708. doi: 10.1016/j.prp.2019.152708
[20] SERRANO C, MARIÑO-ENRÍQUEZ A, TAO D L, et al. Complementary activity of tyrosine kinase inhibitors against secondary kit mutations in imatinib-resistant gastrointestinal stromal tumours[J]. Br J Cancer, 2019, 120(6): 612-620. http://www.nature.com/articles/s41416-019-0389-6
-
期刊类型引用(4)
1. 张寒,郝梦桃,王可心,张正国,艾奕锟,罗亚萍,郜晨静,张静. 生腺布液汤对干燥综合征NOD小鼠B细胞活化因子及B细胞活化因子受体表达的影响. 陕西中医. 2024(08): 1036-1041 .  百度学术
百度学术
2. 孙红艳,吕安坤. 原发性干燥综合征与miRNA-146a相关性的Meta分析. 标记免疫分析与临床. 2022(07): 1122-1126 .  百度学术
百度学术
3. 王菲,时美红. 原发性干燥综合征患者唇腺组织中BTB/POZ结构域蛋白7及基质金属蛋白酶-9的表达与自身抗体的关系. 实用临床医药杂志. 2022(21): 98-102 .  本站查看
本站查看
4. 郭小静,刘维,卡玉秀,丁久力,岳青云,林芳芳,陈婌娟,顾庆香. 白芍总苷治疗干燥综合征的研究进展. 天津中医药. 2022(12): 1627-1632 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
