Effects of ten-eleven translocation-2 on proliferation and migration as well as invasion of non-small cell lung cancer and its mechanism
-
摘要:目的 探讨甲基双加氧酶(TET2)对非小细胞肺癌(NSCLC)细胞增殖、迁移和侵袭能力的影响及其作用机制。方法 通过在线数据库分析TET2与NSCLC患者预后的相关性;实时荧光定量聚合酶链反应(qRT-PCR)、Western blot检测人正常支气管上皮细胞及非小细胞肺癌系中TET2的表达;瞬时转染si-TET2干扰序列,运用CCK8、克隆形成法检测细胞的增殖;Transwell法检测细胞的迁移和侵袭;流式细胞术检测细胞周期变化;Western blot检测上皮间质转化(EMT)标志物以及N-cadherin、E-cadherin、Vimentin、Cyclin D1蛋白水平。结果 TET2高表达的患者总体生存率差,相比于人正常肺上皮细胞,TET2在NSCLC细胞株中高表达。敲低TET2可显著抑制A549、H1299细胞的增殖、迁移和侵袭(P < 0.001),并将细胞周期阻滞于G0/G1期。Western blot结果显示,N-cadherin、Vimentin和Cyclin D1蛋白表达显著下调,E-cadherin表达显著上调(P < 0.05或P < 0.01或P < 0.001)。结论 TET2可能通过影响细胞周期以及EMT的关键蛋白促进NSCLC的增殖、迁移和侵袭。Abstract:Objective To discuss the effect of ten-eleven tanslocation-2 (TET2) on the proliferation, migration and invasion of non-small cell lung cancer (NSCLC) and its mechanism.Methods Online databases were used to detect the correlation between TET2 expression and prognosis of NSCLC patients; quantitative real-time polymerase chain reaction (qRT-PCR) and Western blot were performed to detect the expression of TET2 bronchial epithelial cells and non-small cell lung cancer lines; after transient transfection with si-TET2, cell proliferation were detected by CCK8 and clonogenic assay; Transwell assay was used to detect cell migration and invasion; cell cycle changes were detected by flow cytometry; epithelial-mesenchymal transition (EMT) markers and protein levels of N-cadherin, E-cadherin Vimentin and Cyclin D1 were detected by Western blot.Results Patients with high TET2 expression had poor overall survival. Compared with normal human lung epithelial cells, TET2 is highly expressed in NSCLC cell lines. TET2 knockdown significantly inhibited the proliferation, migration and invasion of A549 and H1299 cells (P < 0.001), and blocked the cell cycle in the G0/G1 phase. Western blot results showed that the protein expressions of N-cadherin, Vimentin and Cyclin D1 were significantly down-regulated, while the expression of E-cadherin was significantly up-regulated (P < 0.05, P < 0.01 or P < 0.001).Conclusion TET2 may promote the proliferation, migration and invasion of NSCLC by affecting the cell cycle and key proteins of EMT.
-
肺癌是一类恶性程度极高的癌症,在所有癌症种类中死亡率居首位。在新诊断的肺癌病例中,约85%被诊断为非小细胞肺癌(NSCLC)[1], 患者5年生存率仅为24%, 腺癌(LUAD)是NSCLC的主要组织学类型[2]。甲基双加氧酶(TET2)是TET蛋白家族的一员,可催化5-甲基胞嘧啶(5mC)羟基化的酶活性[3]。研究[4]证实TET2的高表达与肝癌、白血病患者的不良预后相关,同时TET2可以通过抑制CD86来抑制自身免疫[5-6]。有关TET2在NSCLC中的作用研究较少,本研究探索TET2对NSCLC细胞增殖、迁移和侵袭能力的影响及可能机制,现报告如下。
1. 材料和方法
1.1 材料
人NSCLC细胞株A549、H1299、H460、SPC-A1和人正常支气管上皮细胞BEAS-2B均从中国上海中科院细胞库/干细胞库购买; TET2引物(Genewiz公司); Trizol、逆转录聚合酶链反应(RT-PCR)试剂盒(TaKaRa公司); Lip 2 000转染试剂(Thermo公司); 胎牛血清(Gibco公司); RPMI-1640培养基(Corning公司); 抗体: TET2(Millipore公司)、E-cadherin、N-cadherin、Vimentin、Cyclin D1和β-actin抗体及二抗(CST公司)。
1.2 方法
1.2.1 细胞培养
A549、H1299、H460、SPC-A1和BEAS-2B均使用RPMI-1640培养基培养,培养基于培养细胞前均加入10%胎牛血清配制成完全培养基,置于37 ℃、5%CO2恒温培养箱中培养。
1.2.2 瞬时转染
细胞于前1 d铺板至六孔板中,第2天观察细胞密度为50%~60%即可进行转染,转染步骤严格按照说明书进行。
1.2.3 细胞内TET2 mRNA的检测
Tizol裂解细胞后提取总RNA,按照试剂盒说明书进行反转录及RT-PCR检测。TET2上游引物序列为5′-GATAGAACCAACCATGTTGAGGG-3′, 下游引物序列为5′-TGGAGCTTTGTAGCCAGAGGT-3′。
1.2.4 CCK8和克隆形成实验
将转染完成的细胞消化计数后,按每孔3 000个细胞的密度铺至96孔板中,并进行CCK8实验。第2天每孔中加入10 μL CCK8试剂,于培养箱中培养2 h后,用酶标仪测定吸光度差值,绘制增殖曲线。将3 000个细胞加入60 mm培养皿中,约50个集落形成后即中止培养,用甲醇固定细胞后加入结晶紫染色,计数克隆数。
1.2.5 Transwell实验
预先向侵袭实验的小室中加入基质胶,培养箱中孵育2 h。将转染完成的细胞消化计数,迁移实验上室中加入40 000个细胞,侵袭实验加入60 000个,24 h后甲醇固定结晶紫染色,棉签擦去未穿透的细胞,于镜下200倍视野下拍照计数。
1.2.6 Western blot实验
用RIPA提取细胞总蛋白,每60 μL样品加入16 μL 5×loading buffer和4 μL二硫苏糖醇(DTT)。电泳完成后,湿转2 h, 封闭1 h后一抗4 ℃孵育过夜。二抗室温孵育2 h, 用增强化学发光法(ECL)显影对条带进行显色。
1.2.7 流式细胞术
将转染完成的细胞加入70%乙醇固定过夜,用PI染色液对细胞进行染色,上机进行细胞计数。
1.3 统计学分析
数据统计均使用GraphPad Prism 8.0以分析,数据结果均以(x±s)表示,组间均数比较采用Studen′s t检验。P<0.05为差异有统计学意义。
2. 结果
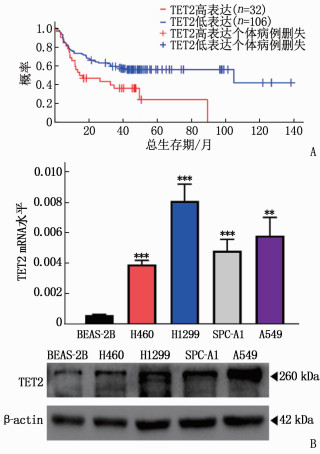
2.1 TET2在NSCLC细胞株中高表达且与患者预后相关
在线数据库显示TET2的高表达与肺腺癌患者的不良预后相关,见图 1A。NSCLC细胞株中TET2的mRNA以及蛋白表达量均高于人正常肺上皮细胞,差异有统计学意义(P<0.01或P<0.001), 见图 1B。
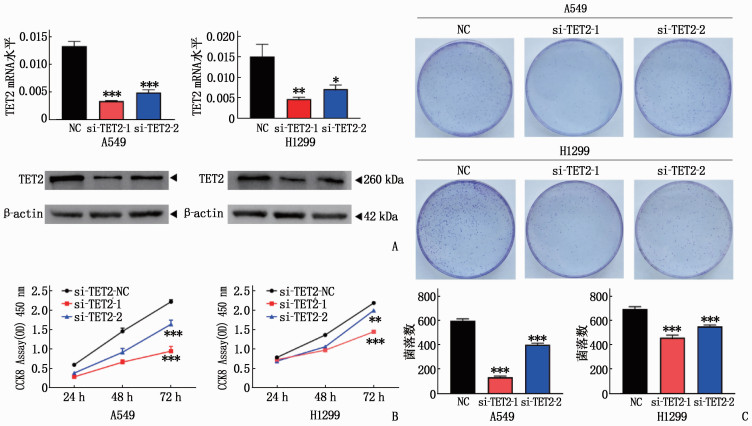
2.2 敲低TET2可以抑制NSCLC细胞株的增殖能力
瞬时转染si-TET2后,A549和H1299细胞中TET2的mRNA和蛋白表达均低于对照组,差异有统计学意义(P<0.05或P<0.01或P<0.001), 见图 2A; CCK8(图 2B)以及克隆形成(图 2C)结果提示敲低TET2, NSCLC细胞株增殖能力被显著抑制(P<0.01或P<0.001)。
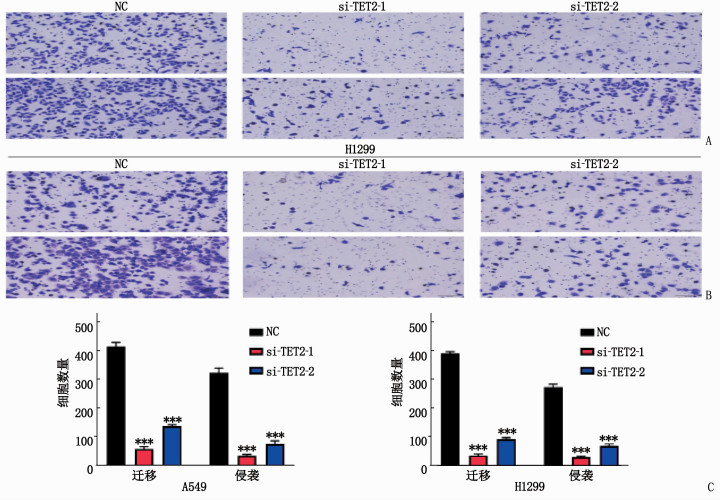
2.3 敲弱TET2可以抑制NSCLC细胞株的迁移和侵袭能力
干扰TET2后, A549和H1299细胞的迁移和侵袭能力显著减弱(P<0.001), 见图 3。
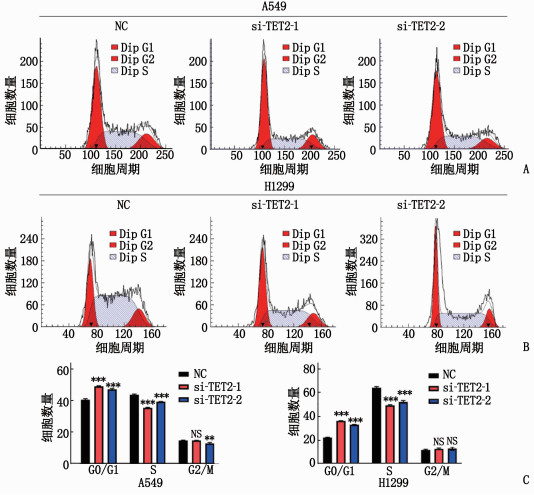
2.4 敲弱TET2阻滞细胞周期于G0/G1期
敲弱TET2可以将细胞阻滞于G0/G1期,并降低S期细胞比例,见图 4。
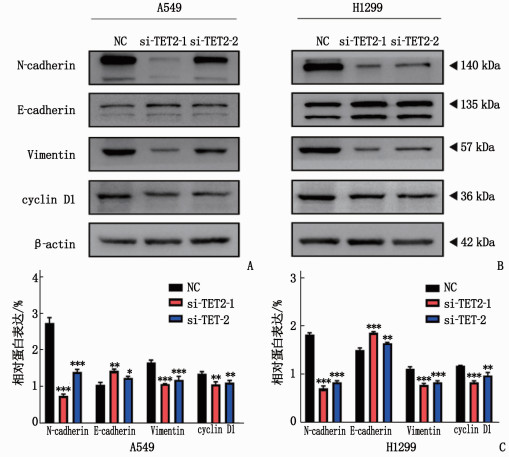
2.5 TET2对EMT标志物和细胞周期蛋白的影响
在A549、H1299细胞中,敲低TET2后, N-cadherin、Vimentin和Cyclin D1蛋白的表达显著下调, E-cadherin的表达显著上调,见图 5。
3. 讨论
TET2作为去甲基化蛋白家族中的一员,已有研究[7]报道同一蛋白家族的TET1在NSCLC中的高表达与患者的不良预后相关。TET2在多种疾病的发生、发展中均扮演了重要的角色,已有研究[4]证实TET2的高表达与肝癌、白血病患者的不良预后相关,同时TET2可以通过抑制CD86来抑制自身免疫[5-6], 但TET2在肺癌中的功能尚未阐明。本研究通过数据库发现TET2的高表达与NSCLC患者的不良预后相关,并证实TET2可以通过调控细胞周期和EMT进程,促进NSCLC的增殖、迁移和侵袭能力。
TET2作为去甲基化蛋白可以参与甲基化过程,甲基化是指在DNA甲基转移酶的催化下,在胞嘧啶的C5位上面加上一个甲基,形成5-甲基胞嘧啶的化学修饰过程,其过程受甲基化酶和去甲基化酶的严格调控[8]。甲基化主要发生在NSCLC的早期阶段,研究[9]表明,BALF的SHOX2/RASSF1A甲基化检测对Ⅰ期的肺癌患者有极高的检出率,为85.7%, 远高于血清CEA和细胞学的10.7%和46.4%。另一项研究[10]通过检测患者外周血ctDNA中的SHOX2、PTGER4和IDH1的甲基化频率,证实这3个基因的联合诊断效能显著高于单一标志物对肺癌患者的诊断效能。故寻找TET2的甲基化修饰蛋白,发掘新的NSCLC的甲基化诊断标志物,并通过非侵入性手段检测外周血基因的甲基化频率,可在提高诊断效能的同时,加强NSCLC的早筛早诊,为其诊断提供新的策略。EMT是指上皮细胞丢失原本具有的细胞间的紧密连接,向间质细胞的形态和特性转变的过程[11-12]。研究[13-15]证实, EMT过程可以促进肺癌、黑色素瘤和乳腺癌的转移。本研究发现,干扰TET2后可以逆转EMT进程。EMT在靶向治疗后的耐药研究[16-17]中同样被证实具有重要作用,逆转EMT进程对细胞恢复对靶向药物的敏感性发挥重大作用,但TET2在耐药过程中发挥的作用本研究并未进一步探索。
综上所述, TET2在NSCLC细胞株中高表达,并且可以通过影响细胞周期EMT进程,促进NSCLC细胞的增殖、迁移和侵袭,针对此靶点可以为NSCLC的治疗和诊断提供新的策略。
-
-
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. doi: 10.3322/caac.21590
[2] MCGUIRE S. World cancer report 2014. Geneva, Switzerland: World Health Organization, international agency for research on cancer, WHO press, 2015[J]. Adv Nutr, 2016, 7(2): 418-419. doi: 10.3945/an.116.012211
[3] ROSS S E, BOGDANOVIC O. TET enzymes, DNA demethylation and pluripotency[J]. Biochem Soc Trans, 2019, 47(3): 875-885. doi: 10.1042/BST20180606
[4] YANG G H, ZENG X, WANG M C, et al. The TET2/E-cadherin/β-catenin regulatory loop confers growth and invasion in hepatocellular carcinoma cells[J]. Exp Cell Res, 2018, 363(2): 218-226. doi: 10.1016/j.yexcr.2018.01.011
[5] TANAKA S, ISE W, INOUE T, et al. Tet2 and Tet3 in B cells are required to repress CD86 and prevent autoimmunity[J]. Nat Immunol, 2020, 21(8): 950-961. doi: 10.1038/s41590-020-0700-y
[6] SHAIKH A R K, UJJAN I, IRFAN M, et al. TET2 mutations in acute myeloid leukemia: a comprehensive study in patients of Sindh, Pakistan[J]. PeerJ, 2021, 9: e10678. doi: 10.7717/peerj.10678
[7] AHN H, LEE H J, LEE J H, et al. Clinicopathological correlation of PD-L1 and TET1 expression with tumor-infiltrating lymphocytes in non-small cell lung cancer[J]. Pathol Res Pract, 2020, 216(11): 153188. doi: 10.1016/j.prp.2020.153188
[8] MARTISOVA A, HOLCAKOVA J, IZADI N, et al. DNA methylation in solid tumors: functions and methods of detection[J]. Int J Mol Sci, 2021, 22(8): 4247. doi: 10.3390/ijms22084247
[9] ZHANG C Z, YU W J, WANG L, et al. DNA methylation analysis of the SHOX2 and RASSF1A panel in bronchoalveolar lavage fluid for lung cancer diagnosis[J]. J Cancer, 2017, 8(17): 3585-3591. doi: 10.7150/jca.21368
[10] ZANG R C, WANG X F, JIN R S, et al. Translational value of IDH1 and DNA methylation biomarkers in diagnosing lung cancers: a novel diagnostic panel of stage and histology-specificity[J]. J Transl Med, 2019, 17(1): 430. doi: 10.1186/s12967-019-2117-7
[11] MENJU T, DATE H. Lung cancer and epithelial-mesenchymal transition[J]. Gen Thorac Cardiovasc Surg, 2021, 69(5): 781-789. doi: 10.1007/s11748-021-01595-4
[12] KUMARI N, REABROI S, NORTH B J, et al. Unraveling the molecular Nexus between GPCRs, ERS, and EMT[J]. Mediators Inflamm, 2021: 6655417.
[13] YANG W Q, ZHAO W J, ZHU L L, et al. XMD-17-51 inhibits DCLK1 kinase and prevents lung cancer progression[J]. Front Pharmacol, 2021, 12: 603453. doi: 10.3389/fphar.2021.603453
[14] LUAN W K, DING Y T, XI H L, et al. Exosomal miR-106b-5p derived from melanoma cell promotes primary melanocytes epithelial-mesenchymal transition through targeting EphA4[J]. J Exp Clin Cancer Res, 2021, 40(1): 107. doi: 10.1186/s13046-021-01906-w
[15] CHANDRASEKARAN J, BALASUBRAMANIAM J, SELLAMUTHU A, et al. An in vitro study on the reversal of epithelial to mesenchymal transition by brusatol and its synergistic properties in triple-negative breast cancer cells[J]. J Pharm Pharmacol, 2021, 73(6): 749-757. doi: 10.1093/jpp/rgab018
[16] SEO J, HA J, KANG E, et al. The role of epithelial-mesenchymal transition-regulating transcription factors in anti-cancer drug resistance[J]. Arch Pharm Res, 2021, 44(3): 281-292. doi: 10.1007/s12272-021-01321-x
[17] NURWIDYA F, TAKAHASHI F, WINARDI W, et al. Zinc-finger E-box-binding homeobox 1(ZEB1) plays a crucial role in the maintenance of lung cancer stem cells resistant to gefitinib[J]. Thorac Cancer, 2021, 12(10): 1536-1548. doi: 10.1111/1759-7714.13937
-
期刊类型引用(1)
1. 尹航. 驱动基因阳性非小细胞肺癌的免疫检查点抑制剂治疗的研究进展. 实用临床医药杂志. 2023(10): 144-148 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号