Expression of mesenchymal-epithelial transition factor and fatty acid synthase in triple-negative breast cancer and their impacs on prognosis
-
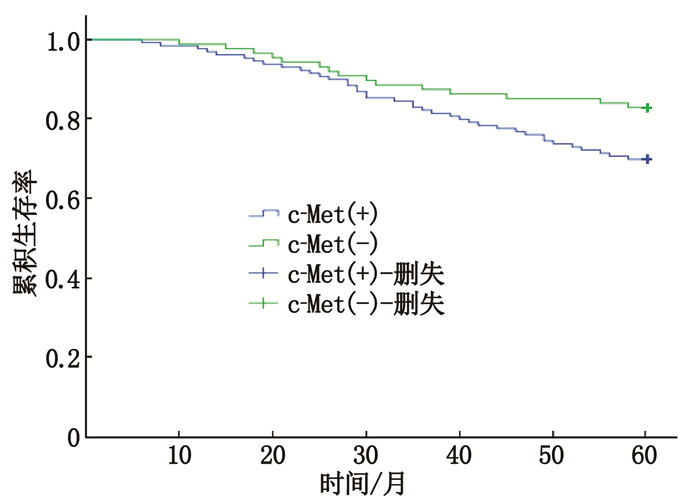
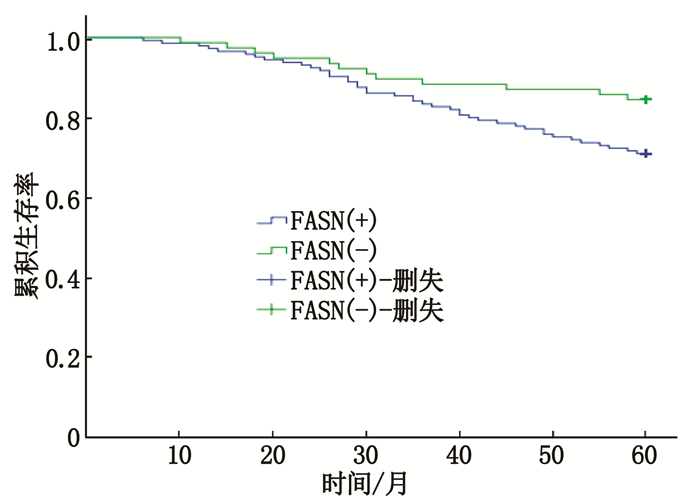
摘要:目的 观察间质-上皮细胞转化因子(c-Met)及脂肪酸合成酶(FASN)在三阴性乳腺癌患者中的表达情况及对预后的影响。方法 采用免疫组织化学染色法(SP)检测218例三阴性乳腺癌组织及癌旁组织中c-Met及FASN蛋白的表达水平,观察c-Met及FASN阳性表达情况,并探讨其与临床病理特征的关系及对预后的影响。结果 218例患者中c-Met阳性表达130例(59.6%),FASN阳性表达142例(65.1%),高于癌旁组织,且c-Met及FASN阳性表达与患者腋窝淋巴结转移情况、TNM分期和组织学分级相关(P < 0.05),但与肿瘤直径无关(P>0.05)。FASN阳性表达与糖尿病及体质量指数相关。生存分析显示,三阴性乳腺癌患者c-Met及FASN阳性表达患者的5年无瘤生存期短于阴性表达患者(P < 0.05)。结论 c-Met及FASN阳性表达参与了三阴性乳腺癌的侵袭、发展、复发及转移过程,可作为判断三阴性乳腺癌预后不良的生物学指标。
-
关键词:
- 间质-上皮细胞转化因子 /
- 脂肪酸合成酶 /
- 三阴性乳腺癌 /
- 预后 /
- 无瘤生存期
Abstract:Objective To observe the expression of mesenchymal-epithelial transition factor (c-Met) and fatty acid synthase(FASN) in patients with triple-negative breast cancer, and their impacts on prognosis.Methods Immunohistochemical staining (SP) method was used to detect the expression levels of c-Met and FASN protein in 218 cases of triple-negative breast cancer tissues and adjacent tissues, and the relationships between positive expression of c-Met, FASN and clinicopathological characteristics as well as their impacts on prognosis.Results Among 218 patients, 130 cases (59.6%) had positive c-Met expression, and 142 cases (65.1%) had FASN positive expression, which were significantly higher than those of the adjacent tissues, and the positive expression levels of c-Met and FASN were correlated with axillary lymph node metastasis, TNM staging and histological grading (P < 0.05). However, they were not correlated with tumor diameter (P>0.05). Positive expression of FASN was also related to diabetes and body mass index. Survival analysis showed that the five-year tumor-free survival of triple negative breast cancer patients with positive expression of c-Met and FASN protein was significantly shorter than those of negative expression ones (P < 0.05).Conclusion The positive expression of c-Met and FASN is involved in the invasion, development, recurrence and metastasis of triple-negative breast cancer, and can be used as one of the biological indicators to judge the poor prognosis of triple-negative breast cancer. -
年龄相关性白内障(ARC)为世界首位致盲性眼病,是一种衰老相关的慢性病,其发病率随年龄增长而增加[1-2]。目前,对ARC发生发展的具体分子机制仍然缺乏较全面的了解。长链非编码RNA(LncRNA)是长度大于200个核苷酸的非编码RNA, 可在基因的转录、转录后和翻译后等水平调控其表达,在多种生理学和病理学过程中发挥重要作用[3]。研究[4]发现大量LncRNA参与细胞衰老及相关信号通路的调控,影响关键细胞周期过程,如细胞增殖、分化、静止、衰老等。这类衰老相关LncRNA通过表观遗传调控、细胞增殖、端粒稳定性、蛋白质内稳态、细胞间通讯、干细胞池等调控衰老[5]。本研究探讨衰老相关LncRNA PINT对ARC发生发展的影响,现报告如下。
1. 材料与方法
1.1 研究对象
病例组(ARC组):在扬州大学附属医院眼科被诊断为ARC、接受白内障小切口手法碎核白内障手术患者。收集中度皮质性ARC、重度皮质性ARC、中度核性ARC、重度核性ARC各10眼。纳入标准: 患者年龄50~79岁; 最佳矫正视力低于0.5; 排除标准: 先天性、糖尿病性、外伤性、并发性、药物及中毒性白内障等患者。所有参加研究的患者均无高血压病、糖尿病、自身免疫性疾病及其他氧化损伤性相关疾病。
对照组: ①在扬州大学附属医院眼科被诊断为玻璃体视网膜疾病(如特发性黄斑前膜、特发性黄斑裂孔等),因年龄和手术等因素需要在玻璃体切除手术中同时行透明晶状体摘除者,共10眼。②扬州市红十字眼库捐献的新鲜眼球。纳入标准[6]: 年龄50~79岁; 晶状体透明。排除标准: 高血压病、糖尿病、自身免疫病及其他氧化损伤性相关疾病者。研究对象签署知情同意书。③人晶状体上皮细胞株SRA01/04(Thermo Fisher Scientific公司)。上述研究方案严格遵循赫尔辛基宣言,且经扬州大学医学院伦理委员会批准。
1.2 RNA提取、逆转录和实时荧光定量PCR
使用TRIzol试剂(Invitrogen, Carlsbad, CA, United States)从ARC和对照组细胞中提取总RNA, 然后使用PrimeScript RT Master Mix(Takara, 中国大连)、Power SYBR Green PCR Master Mix(Applied Biosystems, Irvine, CA, United States)在ABI 7500实时PCR系统上进行实时PCR分析。选用actin beta作为内参,每个实验重复3次。
1.3 细胞培养和处理
人晶状体上皮细胞株SRA01/04起源于人晶状体上皮细胞,将其培养在DMEM中,含有10%胎牛血清(FBS), 青霉素(100单位/mL)和链霉素(100 μg/mL)。所有细胞在37 ℃, 95%空气和5%二氧化碳的加湿培养箱中培养。氧化损伤组:当生长至80%~90%时,将细胞暴露于过氧化氢(H2O2)(Sigma-Aldrich Corp., St Louis, MO, USA)中,进行氧化损伤。将细胞在含2%FBS的DMEM中孵育过夜,然后在无血清DMEM中孵育30 min。用H2O2(100和200μmol/L)处理24 h后,收集细胞进行不同的测定。衰老组:当细胞生长至80%~90%时,将细胞暴露于小剂量H2O2进行衰老处理。将细胞在含2% FBS的DMEM中孵育过夜,然后在无血清DMEM中孵育30 min, 并用50 μmol/L H2O2培养至7、14、21 d。实验结束时,收取所有细胞并用于不同的检测。平行培养的对照细胞在类似的培养基中生长,不进行处理,作为所有实验的对照。
1.4 质粒构建、慢病毒包装和转染
使用pCDNA3.1载体(Genechem Technology Co., Shanghai, China)。过表达LINC-PINT: 通过PCR生成LINC-PINT序列并克隆到pcDNA3.1载体中。慢病毒包装:将pcDNA、pcDNA-LINC-PINT、si-NC、si-LINC-PINT分别转染进人晶状体上皮细胞株SRA01/04中,转染6 h后,更换新鲜培养液继续培养48 h, 检测转染效率。转染成功后,用于后续实验。
1.5 细胞增殖能力测定
利用CCK8检测试剂盒(Dojindo Laboratories, Kumamoto, Japan)检测各组细胞的生长增殖情况,分别向处理或未处理的细胞中加入10 μL CCK8试剂, 37 ℃避光孵育3 h, 酶标仪检测450 nm处的吸光度(OD值),实验重复3次。
1.6 抗氧化能力检测
总抗氧化能力(T-AOC)检测试剂盒(FRAP法)测定总抗氧化水平。在酸性环境下,还原铁-三吡啶三吖嗪(Fe3+-TPTZ)产生亚铁离子(Fe2+)形式的能力反映了总抗氧化能力。收集100~200万个细胞,加入1.0 mL预冷的提取液,超声充分破碎细胞并释放其中的抗氧化物, 4 ℃、10 000次/min, 离心5 min, 取上清液。样品的抗氧化能力以达到同样吸光度变化值所需的标准液离子浓度表示。
1.7 染色质免疫共沉淀(ChIP)技术
ChIP测定: 使用EZ-Magna ChIP A/G试剂盒(Millipore), 应用抗EZH2(Active Motif)和抗H3K27me3(Active Motif)。将SRA01/04细胞与1%甲醛交联8 min, 然后匀浆。使用Branson Digital Sonifier(Model 450; Branson Ultrasonics Corporation, CT, USA)的微尖探针将匀浆在2级超声处理4次,每次15 s, 每次脉冲之间在冰上间隔40 s, 产生长度为200~800碱基对(bp)的DNA片段。ChIP分析:将等量处理过的染色质添加到含有针对目标蛋白的固定化抗体或阴性对照正常兔IgG抗体的微孔中。在65 ℃温育90 min以逆转交联并洗脱DNA后,使用快速旋转柱进行DNA纯化,然后进行实时PCR检测。
1.8 统计分析
采用IBM SPSS Statistics 20.0软件进行数据分析,所有结果数据以平均值±标准差表示。2组之间的差异采用非配对的Student′s t检验或方差分析进行比较。P < 0.05为差异具有统计学意义。
2. 结果
2.1 LINC-PINT在ARC中的表达
使用高通量RNA序列分析、确定ARC组和对照组晶状体上皮细胞之间的差异表达。ARC组LINC-PINT的表达水平高于对照组,差异有统计学意义(P < 0.05)。LINC-PINT的表达水平与ARC分级呈正相关。见图 1。
2.2 衰老相关LncRNA与氧化损伤/衰老的关系
在晶状体上皮细胞中,氧化损伤组和衰老组中LINC-PINT表达水平高于对照组,差异有统计学意义(P < 0.05), 且分别呈现为剂量依赖性或时间依赖性的正相关,见图 2、图 3。
2.3 建立过表达/敲低模型
将pcDNA、pcDNA-LINC-PINT、si-NC、si-LINC-PINT分别转染进人晶状体上皮细胞SRA01/04中,通过实时荧光定量PCR检测转染前后细胞中相关基因的表达量变化,发现转入pcDNA-LINC-PINT后,靶基因CCNA2、CDK1、PCNA表达减少; 转入si-LINC-PINT后,靶基因CCNA2、CDK1、PCNA表达增加,见图 4。同时, LINC-PINT改变抗氧化损伤能力,见图 5。CCK8显示在LINC-PINT过表达的细胞中细胞增殖被抑制,见图 6。
2.4 衰老相关LncRNA与转录因子的调控机制
在模拟物和LINC-PINT过表达的细胞中进行ChIP, 测定表观遗传修饰物与LINC-PINT靶基因的启动子区域之间的相互作用。LINC-PINT与EZH2相互作用。LINC-PINT将EZH2招募到CDK1、CCNA2和PCNA基因的启动子上,导致H3K27三甲基化和靶基因的表观遗传学沉默。见图 7。
3. 讨论
LncRNA PINT是由p53诱导的核LncRNA, 直接与PRC2相互作用,且是PRC2特异靶基因中的组蛋白H3K27甲基化所必需的。研究[7]表明, LINC-PINT的功能依赖于PRC2的表达水平,并通过与PRC2相互作用调控转化生长因子-β(TGF-β)、丝裂原活化蛋白激酶(MAPK)和p53细胞通路中的蛋白质表达水平,而这些通路与氧化损伤、衰老和衰老相关性疾病有关。p53及其下游p21蛋白是重要的细胞周期相关蛋白,广泛参与了细胞的增殖、分化、凋亡等多种生理及病理过程。研究[4, 8]表明, LncRNA是p53/p21信号通路的重要组成部分,而调控表观遗传学变异的LncRNA PINT在p53/p21信号通路中扮演着重要的角色。p53能通过诱导LncRNA PINT的表达,与PRC2相互作用,从而终止基因转录,调控p53信号通路中蛋白质的表达水平,调控细胞周期进程,从而影响机体的衰老以及衰老相关疾病的发生发展。
ARC与表观遗传因素密不可分。研究[9-10]报道, LncRNA与许多眼病相关,如青光眼、后发性白内障、糖尿病性视网膜病变、增生性玻璃体视网膜病变、眼部肿瘤等。其中有报道[11]表明LncRNA PAUPAR通过调控组蛋白H3K4的去甲基化进而抑制葡萄膜黑色素瘤的发生。作者的前期研究[12-13]提示,在人晶状体上皮细胞株SRA01/04中,高浓度短时间的氧化损伤可诱导氧化损伤模型,而低浓度长时间的氧化损伤可诱导衰老模型。ARC的衰老发病机制与氧化损伤机制紧密相扣,氧化损伤相关的表观遗传学改变与ARC密切相关[14]。因此,衰老相关LncRNA可能通过参与表观遗传学调控影响细胞衰老,进而引起ARC。
本研究初步阐明了LncRNA PINT可能通过p53/p21通路调控相关基因的表观遗传改变,参与ARC的发生发展,揭示了衰老相关LncRNA在ARC发病机制中起到重要作用,可作为ARC防治的新靶点。本研究从表观遗传学水平探讨ARC发病机制,为ARC防治提供新思路,有助于研发抗ARC药物,为进一步深入了解白内障的发病机理提供了理论基础和方向。
-
表 1 c-Met及FASN在TNBC癌组织及癌旁组织中的表达情况[n(%)]
组织 c-Met表达 FASN表达 + - + - 癌组织 130(59.6)* 88(40.4)* 142(65.1)* 76(34.9)* 癌旁组织 65(29.8) 153(70.2) 30(13.8) 188(86.2) c-Met: 间质-上皮细胞转化因子; FASN: 脂肪酸合成酶。
与癌旁组织比较, *P < 0.05。表 2 c-Met及FASN在TNBC组织的表达及与临床病理特征的关系[n(%)]
临床特征 n c-Met表达 χ2 P FASN表达 χ2 P 阳性 阴性 阳性 阴性 肿瘤直径 <2 cm 55 29(52.7) 26(47.3) 1.648 0.439 30(54.5) 25(45.5) 4.114 0.128 2~5 cm 124 78(62.9) 46(37.1) 87(70.2) 37(29.8) >5 cm 39 23(59.0) 16(41.0) 25(64.1) 14(35.9) 腋窝淋巴结 转移 66 46(69.7) 20(30.3) 3.983 0.046 50(75.8) 16(24.2) 4.701 0.030 无转移 152 84(55.3) 68(44.7) 92(60.5) 60(39.5) 临床分期 Ⅰ期 50 22(44.0) 28(56.0) 6.643 0.036 21(42.0) 29(58.0) 16.30 0.001 Ⅱ期 110 70(63.6) 40(36.4) 79(71.8) 31(28.2) Ⅲ期 58 38(65.5) 20(34.5) 42(72.4) 16(27.6) 组织学分级 Ⅰ级 15 5(33.3) 10(66.7) 6.365 0.041 4(26.7) 11(73.3) 11.18 0.004 Ⅱ级 129 75(58.1) 54(41.9) 85(65.9) 44(34.1) Ⅲ级 74 50(67.6) 24(32.4) 53(71.6) 21(28.4) 糖尿病 有 29 16(55.2) 13(44.8) 0.276 0.599 24(82.8) 5(17.2) 4.574 0.032 无 189 114(60.3) 75(39.7) 118(62.4) 71(37.6) 体质量指数 <18.5 kg/m2 4 1(25.0) 3(75.0) 2.053 0.561 0(0.0) 4(100) 13.33 0.004 18.5~<24.0 kg/m2 102 62(60.8) 40(41.2) 60(58.8) 42(41.2) 24.0~<28.0 kg/m2 70 42(60.0) 28(40.0) 49(70.0) 21(30.0) ≥28 kg/m2 42 25(59.5) 17(40.5) 33(78.6) 9(21.4) 表 3 TNBC患者复发远处转移情况[n(%)]
复发转移情况 c-Met表达 FASN表达 + - + - 复发转移(n=54) 39(72.2) 15(27.8) 42(77.8) 12(22.2) 无复发转移(n=164) 91(55.5) 73(44.5) 100(61.0) 64(39.0) -
[1] PRASANNA T, WU F, KHANNA K K, et al. Optimizing poly (ADP-ribose) polymerase inhibition through combined epigenetic and immunotherapy[J]. Cancer Sci, 2018, 109(11): 3383-3392. doi: 10.1111/cas.13799
[2] YI Y W, YOU K, BAE E J, et al. Dual inhibition of EGFR and MET induces synthetic lethality in triple-negative breast cancer cells through downregulation of ribosomal protein S6[J]. Int J Oncol, 2015, 47(1): 122-132. doi: 10.3892/ijo.2015.2982
[3] GAULE P, MUKHERJEE N, CORKERY B, et al. Dasatinib Treatment Increases Sensitivity to c-Met Inhibition in Triple-Negative Breast Cancer Cells[J]. Cancers (Basel), 2019, 11(4): 548-548. doi: 10.3390/cancers11040548
[4] REN X, YUAN L, SHEN S, et al. C-Met and ERβ expression differences in basal-like and non-basal-like triple-negative breast cancer[J]. Tumour Biol, 2016, 37(8): 11385-11395. doi: 10.1007/s13277-016-5010-5
[5] AYOUB N M, AL-SHAMI K M, ALQUDAH M A, et al. Crizotinib, a MET inhibitor, inhibits growth, migration, and invasion of breast cancer cells in vitro and synergizes with chemotherapeutic agents[J]. Onco Targets Ther, 2017, 10: 4869-4883. doi: 10.2147/OTT.S148604
[6] SIMICZYJEW, ALEKSANDRA, DRATKIEWICZ, et al. Combination of EGFR Inhibitor Lapatinib and MET Inhibitor Foretinib Inhibits Migration of Triple Negative Breast Cancer Cell Lines[J]. Cancers, 2018, 10(9): 335-335. doi: 10.3390/cancers10090335
[7] BUENO M J, QUINTELA-FANDINO M. Emerging role of Fatty acid synthase in tumor initiation: implications for cancer prevention[J]. Mol Cell Oncol, 2020, 7(2): 1709389. doi: 10.1080/23723556.2019.1709389
[8] MENENDEZ J A, LUPU R. Fatty acid synthase regulates estrogen receptor-α signaling in breast cancer cells[J]. Oncogenesis, 2017, 6(2): e299. doi: 10.1038/oncsis.2017.4
[9] GIRÓ-PERAFITA A, PALOMERAS S, LUM D H, et al. Preclinical evaluation of fatty acid synthase and EGFR inhibition in triple-negative breast cancer[J]. Clin Cancer Res, 2016, 22(18): 4687-4697. doi: 10.1158/1078-0432.CCR-15-3133
[10] ERICA LEONETTI, LUISA GESUALDI, KATIA CORANO SCHERI, et al. Arnold LEnders JThomas SM. c-Src Recruitment Is Involved in c-Met-Mediated Malignant Behaviour of NT2D1 Non-Seminoma Cells[J]. Int J Mol Sci, 2019, 20(2): 320. doi: 10.3390/ijms20020320
[11] CHUN H W, HONG R. Significance of PD-L1 clones and C-MET expression in hepatocellular carcinoma[J]. Oncol Lett, 2019, 17(6): 5487-5498. http://www.ingentaconnect.com/content/sp/ol/2019/00000017/00000006/art00090
[12] NAN L, QIN T, XIAO Y, et al. Pancreatic stellate cells facilitate perineural invasion of pancreatic cancer via HGF/c-met pathway[J]. Cell Transplant, 2019, 28(9/10): 1289-1298. http://www.researchgate.net/publication/333612428_Pancreatic_Stellate_Cells_Facilitate_Perineural_Invasion_of_Pancreatic_Cancer_via_HGFc-Met_Pathway
[13] LEE S J, LEE J, PARK S H, et al. C-MET overexpression in colorectal cancer: a poor prognostic factor for survival[J]. Clin Colorectal Cancer, 2018, 17(3): 165-169. doi: 10.1016/j.clcc.2018.02.013
[14] ZAGOURI F, BAGO-HORVATH Z, RÖSSLER F, et al. High MET expression is an adverse prognostic factor in patients with triple-negative breast cancer[J]. Br J Cancer, 2013, 108(5): 1100-1105. doi: 10.1038/bjc.2013.31
[15] BREEN L, GAULE P B, CANONICI A, et al. Targeting c-Met in triple negative breast cancer: preclinical studies using the c-Met inhibitor, Cpd A[J]. Investig New Drugs, 2020, 38(5): 1365-1372. doi: 10.1007/s10637-020-00937-y
[16] ZHAO X, QU J, HUI Y, et al. Clinicopathological and prognostic significance of c-Met overexpress-ion in breast cancer[J]. Oncotarget, 2017, 8(34): 56758-56767. doi: 10.18632/oncotarget.18142
[17] KIN Y J, CHOI J S, SEO J, et al. MET is a potential target for use in combination therapy with EGFR inhibition in triple-negative/basal-like breast cancer[J]. Int J Cancer, 2014, 134(10): 2424-2436. doi: 10.1002/ijc.28566
[18] Yi Y W, You K, Bae E J, et al. Dual inhibition of EGFR and MET induces synthetic lethality in triple-negative breast cancer cells through downregulation of ribosomal protein S6[J]. Int J Oncol, 2015, 47(1): 122-132. doi: 10.3892/ijo.2015.2982
[19] SHI B, JIANG Y, CHEN Y, ZHAO Z, et al. Variation in the Fatty Acid Synthase Gene (FASN) and Its Association with Milk Traits in Gannan Yaks[J]. Animals (Basel). 2019, 9(9): 613-613. http://www.researchgate.net/publication/335435976_Variation_in_the_Fatty_Acid_Synthase_Gene_FASN_and_Its_Association_with_Milk_Traits_in_Gannan_Yaks
[20] FLORIS A, MAZAREI M, YANG X, et al. SUMOylation Protects FASN Against Proteasomal Degradation in Breast Cancer Cells Treated with Grape Leaf Extract[J]. Biomolecules, 2020, 10(4): 529. doi: 10.3390/biom10040529
[21] GIRÓ-PERAFITA A, SARRATS A, PÉREZ-BUENO F, et al. Fatty acid synthase expression and its association with clinico-histopathological features in triple-negative breast cancer[J]. Oncotarget, 2017, 8(43): 74391-74405. doi: 10.18632/oncotarget.20152
[22] FONTANELLA C, LEDERER B, GADE S, et al. Impact of body mass index on neoadjuvant treatment outcome: a pooled analysis of eight prospective neoadjuvant breast cancer trials[J]. Breast Cancer Res Treat, 2015, 150(1): 127-139. doi: 10.1007/s10549-015-3287-5
[23] GONDO N, SAWAKI M, HATTORI M, et al. Impact of BMI for clinical outcomes in Japanese breast cancer patients[J]. Jpn J Clin Oncol, 2020, 50(3): 230-240. doi: 10.1093/jjco/hyz175
[24] BAUERSCHLAG D O, MAASS N, LEONHARDT P, et al. Fatty acid synthase overexpression: target for therapy and reversal of chemoresistance in ovarian cancer[J]. J Transl Med, 2015, 13: 146-146. doi: 10.1186/s12967-015-0511-3





 下载:
下载:






 苏公网安备 32100302010246号
苏公网安备 32100302010246号
