Senescence-associated LncRNA PINT influences the development of age-related cataracts through epigenetic modifications
-
摘要:目的 探讨衰老相关长链非编码RNA(LncRNA)PINT对年龄相关性白内障(ARC)发生发展的影响。方法 通过收集不同类型ARC及透明晶状体的上皮细胞,测定衰老相关LncRNA的表达;通过对比ARC组和对照组,筛选衰老相关的差异表达LncRNA PINT。采用实时荧光定量PCR(qRT-PCR)检测ARC组与对照组晶状体上皮细胞中LncRNA PINT的表达水平。使用微阵列测定LINC-PINT的潜在靶基因,以及使用染色质免疫共沉淀(ChIP)验证LncRNA PINT靶基因候选物的状态。建立氧化损伤/衰老模型、过表达/敲低模型,检测LncRNA PINT及相关靶基因的表达水平、细胞抗氧化损伤能力、细胞增殖凋亡情况。结果 ARC组中LncRNA PINT的表达量高于对照组,差异有统计学意义(P < 0.05);氧化损伤/衰老模型中LncRNA PINT的表达量高于对照组,差异有统计学意义(P < 0.05)。敲低模型中LncRNA PINT相关靶基因表达水平显著升高,晶状体上皮细胞抗氧化能力增强(P < 0.05);过表达模型中晶状体上皮细胞增殖减少,凋亡增加(P < 0.05)。结论 衰老相关LncRNA的表达改变可能通过表观遗传学修饰影响机体的衰老和衰老性疾病的形成,与ARC的发生发展相关。Abstract:Objective To investigate the effect of senescence-associated long non-coding RNA (LncRNA) PINT on the development of age-related cataract (ARC).Methods The expression of aging-related LncRNAs was determined by collecting epithelial cells from different types of ARC and clear lens, and the differentiated expression aging-related LncRNA PINT was screened by comparing the ARC group with the control group. Quantitative Real-time PCR (qRT-PCR) was performed to detect the expression levels of LncRNA PINT in the lens epithelial cells of the ARC group and the control group. Microarray assays was used to identify potential LncRNA PINT target genes, and chromatin immunoprecipitation assay (ChIP) was used to verify the status of LncRNA PINT target gene candidates. Oxidative damage/aging model and overexpression/knockdown model were established to detect the expression levels of LncRNA PINT and related target genes, cellular antioxidant damage capacity, cell proliferation and apoptosis.Results The expression level of LncRNA PINT in ARC group was significantly higher than that in control group (P < 0.05). The expression level of LncRNA PINT in oxidative damage/aging model was significantly higher than that in control group (P < 0.05). In knockdown model, the expression level of LncRNA PINT related target genes was significantly increased, and the antioxidant capacity of lens epithelial cells was enhanced (P < 0.05). In the overexpression model, lens epithelial cells showed decreased proliferation and increased apoptosis (P < 0.05).Conclusion Changes in expression of senescence-associated LncRNAs may affect aging and senile disease formation in the organism through epigenetic modifications, which are associated with the development of ARC.
-
Keywords:
- age-related cataract /
- aging /
- long non-coding RNA /
- epigenetics /
- oxidative damage
-
年龄相关性白内障(ARC)为世界首位致盲性眼病,是一种衰老相关的慢性病,其发病率随年龄增长而增加[1-2]。目前,对ARC发生发展的具体分子机制仍然缺乏较全面的了解。长链非编码RNA(LncRNA)是长度大于200个核苷酸的非编码RNA, 可在基因的转录、转录后和翻译后等水平调控其表达,在多种生理学和病理学过程中发挥重要作用[3]。研究[4]发现大量LncRNA参与细胞衰老及相关信号通路的调控,影响关键细胞周期过程,如细胞增殖、分化、静止、衰老等。这类衰老相关LncRNA通过表观遗传调控、细胞增殖、端粒稳定性、蛋白质内稳态、细胞间通讯、干细胞池等调控衰老[5]。本研究探讨衰老相关LncRNA PINT对ARC发生发展的影响,现报告如下。
1. 材料与方法
1.1 研究对象
病例组(ARC组):在扬州大学附属医院眼科被诊断为ARC、接受白内障小切口手法碎核白内障手术患者。收集中度皮质性ARC、重度皮质性ARC、中度核性ARC、重度核性ARC各10眼。纳入标准: 患者年龄50~79岁; 最佳矫正视力低于0.5; 排除标准: 先天性、糖尿病性、外伤性、并发性、药物及中毒性白内障等患者。所有参加研究的患者均无高血压病、糖尿病、自身免疫性疾病及其他氧化损伤性相关疾病。
对照组: ①在扬州大学附属医院眼科被诊断为玻璃体视网膜疾病(如特发性黄斑前膜、特发性黄斑裂孔等),因年龄和手术等因素需要在玻璃体切除手术中同时行透明晶状体摘除者,共10眼。②扬州市红十字眼库捐献的新鲜眼球。纳入标准[6]: 年龄50~79岁; 晶状体透明。排除标准: 高血压病、糖尿病、自身免疫病及其他氧化损伤性相关疾病者。研究对象签署知情同意书。③人晶状体上皮细胞株SRA01/04(Thermo Fisher Scientific公司)。上述研究方案严格遵循赫尔辛基宣言,且经扬州大学医学院伦理委员会批准。
1.2 RNA提取、逆转录和实时荧光定量PCR
使用TRIzol试剂(Invitrogen, Carlsbad, CA, United States)从ARC和对照组细胞中提取总RNA, 然后使用PrimeScript RT Master Mix(Takara, 中国大连)、Power SYBR Green PCR Master Mix(Applied Biosystems, Irvine, CA, United States)在ABI 7500实时PCR系统上进行实时PCR分析。选用actin beta作为内参,每个实验重复3次。
1.3 细胞培养和处理
人晶状体上皮细胞株SRA01/04起源于人晶状体上皮细胞,将其培养在DMEM中,含有10%胎牛血清(FBS), 青霉素(100单位/mL)和链霉素(100 μg/mL)。所有细胞在37 ℃, 95%空气和5%二氧化碳的加湿培养箱中培养。氧化损伤组:当生长至80%~90%时,将细胞暴露于过氧化氢(H2O2)(Sigma-Aldrich Corp., St Louis, MO, USA)中,进行氧化损伤。将细胞在含2%FBS的DMEM中孵育过夜,然后在无血清DMEM中孵育30 min。用H2O2(100和200μmol/L)处理24 h后,收集细胞进行不同的测定。衰老组:当细胞生长至80%~90%时,将细胞暴露于小剂量H2O2进行衰老处理。将细胞在含2% FBS的DMEM中孵育过夜,然后在无血清DMEM中孵育30 min, 并用50 μmol/L H2O2培养至7、14、21 d。实验结束时,收取所有细胞并用于不同的检测。平行培养的对照细胞在类似的培养基中生长,不进行处理,作为所有实验的对照。
1.4 质粒构建、慢病毒包装和转染
使用pCDNA3.1载体(Genechem Technology Co., Shanghai, China)。过表达LINC-PINT: 通过PCR生成LINC-PINT序列并克隆到pcDNA3.1载体中。慢病毒包装:将pcDNA、pcDNA-LINC-PINT、si-NC、si-LINC-PINT分别转染进人晶状体上皮细胞株SRA01/04中,转染6 h后,更换新鲜培养液继续培养48 h, 检测转染效率。转染成功后,用于后续实验。
1.5 细胞增殖能力测定
利用CCK8检测试剂盒(Dojindo Laboratories, Kumamoto, Japan)检测各组细胞的生长增殖情况,分别向处理或未处理的细胞中加入10 μL CCK8试剂, 37 ℃避光孵育3 h, 酶标仪检测450 nm处的吸光度(OD值),实验重复3次。
1.6 抗氧化能力检测
总抗氧化能力(T-AOC)检测试剂盒(FRAP法)测定总抗氧化水平。在酸性环境下,还原铁-三吡啶三吖嗪(Fe3+-TPTZ)产生亚铁离子(Fe2+)形式的能力反映了总抗氧化能力。收集100~200万个细胞,加入1.0 mL预冷的提取液,超声充分破碎细胞并释放其中的抗氧化物, 4 ℃、10 000次/min, 离心5 min, 取上清液。样品的抗氧化能力以达到同样吸光度变化值所需的标准液离子浓度表示。
1.7 染色质免疫共沉淀(ChIP)技术
ChIP测定: 使用EZ-Magna ChIP A/G试剂盒(Millipore), 应用抗EZH2(Active Motif)和抗H3K27me3(Active Motif)。将SRA01/04细胞与1%甲醛交联8 min, 然后匀浆。使用Branson Digital Sonifier(Model 450; Branson Ultrasonics Corporation, CT, USA)的微尖探针将匀浆在2级超声处理4次,每次15 s, 每次脉冲之间在冰上间隔40 s, 产生长度为200~800碱基对(bp)的DNA片段。ChIP分析:将等量处理过的染色质添加到含有针对目标蛋白的固定化抗体或阴性对照正常兔IgG抗体的微孔中。在65 ℃温育90 min以逆转交联并洗脱DNA后,使用快速旋转柱进行DNA纯化,然后进行实时PCR检测。
1.8 统计分析
采用IBM SPSS Statistics 20.0软件进行数据分析,所有结果数据以平均值±标准差表示。2组之间的差异采用非配对的Student′s t检验或方差分析进行比较。P < 0.05为差异具有统计学意义。
2. 结果
2.1 LINC-PINT在ARC中的表达
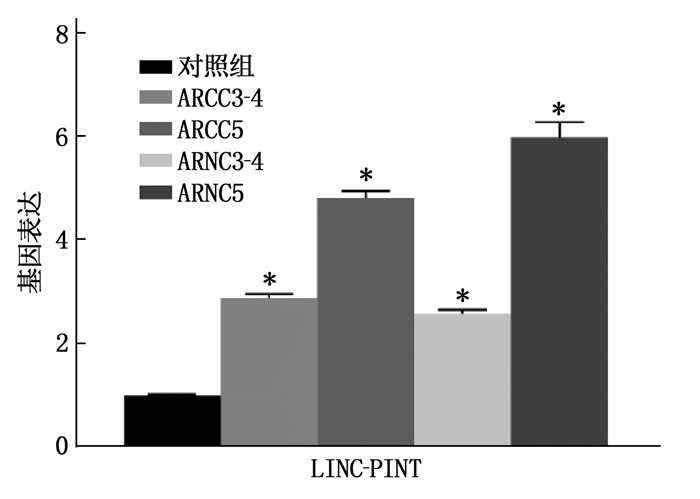
使用高通量RNA序列分析、确定ARC组和对照组晶状体上皮细胞之间的差异表达。ARC组LINC-PINT的表达水平高于对照组,差异有统计学意义(P < 0.05)。LINC-PINT的表达水平与ARC分级呈正相关。见图 1。
2.2 衰老相关LncRNA与氧化损伤/衰老的关系
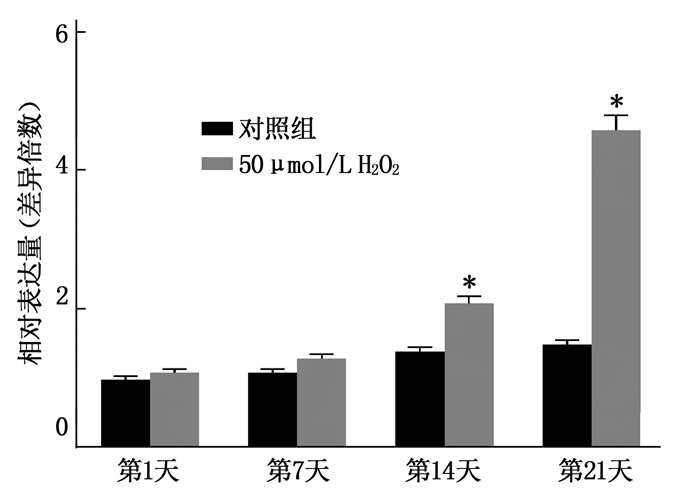
在晶状体上皮细胞中,氧化损伤组和衰老组中LINC-PINT表达水平高于对照组,差异有统计学意义(P < 0.05), 且分别呈现为剂量依赖性或时间依赖性的正相关,见图 2、图 3。
2.3 建立过表达/敲低模型
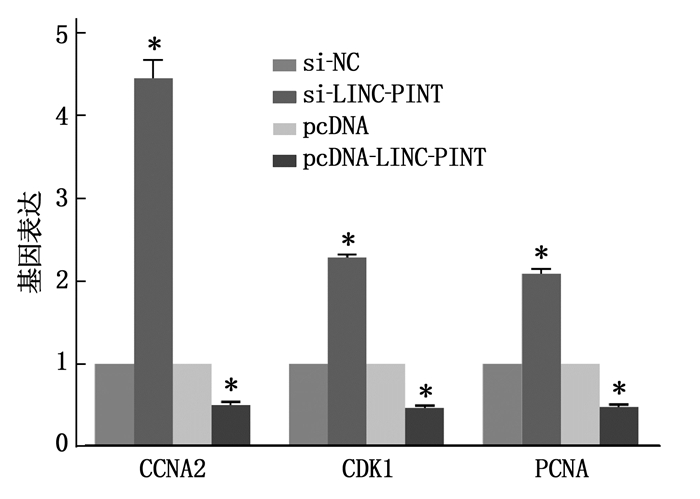
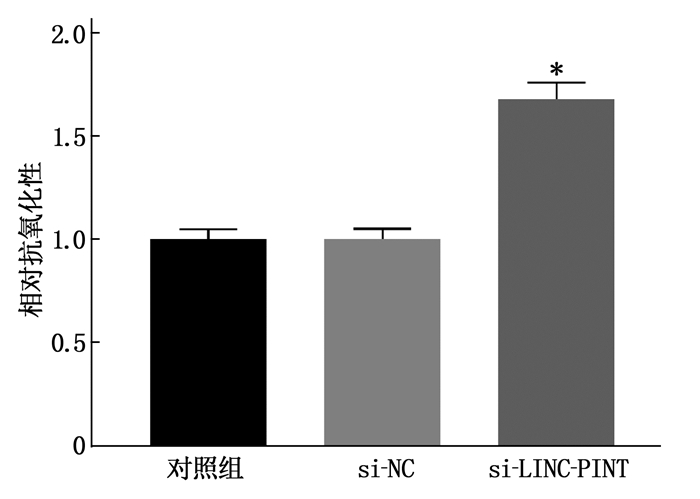
将pcDNA、pcDNA-LINC-PINT、si-NC、si-LINC-PINT分别转染进人晶状体上皮细胞SRA01/04中,通过实时荧光定量PCR检测转染前后细胞中相关基因的表达量变化,发现转入pcDNA-LINC-PINT后,靶基因CCNA2、CDK1、PCNA表达减少; 转入si-LINC-PINT后,靶基因CCNA2、CDK1、PCNA表达增加,见图 4。同时, LINC-PINT改变抗氧化损伤能力,见图 5。CCK8显示在LINC-PINT过表达的细胞中细胞增殖被抑制,见图 6。
2.4 衰老相关LncRNA与转录因子的调控机制
在模拟物和LINC-PINT过表达的细胞中进行ChIP, 测定表观遗传修饰物与LINC-PINT靶基因的启动子区域之间的相互作用。LINC-PINT与EZH2相互作用。LINC-PINT将EZH2招募到CDK1、CCNA2和PCNA基因的启动子上,导致H3K27三甲基化和靶基因的表观遗传学沉默。见图 7。
3. 讨论
LncRNA PINT是由p53诱导的核LncRNA, 直接与PRC2相互作用,且是PRC2特异靶基因中的组蛋白H3K27甲基化所必需的。研究[7]表明, LINC-PINT的功能依赖于PRC2的表达水平,并通过与PRC2相互作用调控转化生长因子-β(TGF-β)、丝裂原活化蛋白激酶(MAPK)和p53细胞通路中的蛋白质表达水平,而这些通路与氧化损伤、衰老和衰老相关性疾病有关。p53及其下游p21蛋白是重要的细胞周期相关蛋白,广泛参与了细胞的增殖、分化、凋亡等多种生理及病理过程。研究[4, 8]表明, LncRNA是p53/p21信号通路的重要组成部分,而调控表观遗传学变异的LncRNA PINT在p53/p21信号通路中扮演着重要的角色。p53能通过诱导LncRNA PINT的表达,与PRC2相互作用,从而终止基因转录,调控p53信号通路中蛋白质的表达水平,调控细胞周期进程,从而影响机体的衰老以及衰老相关疾病的发生发展。
ARC与表观遗传因素密不可分。研究[9-10]报道, LncRNA与许多眼病相关,如青光眼、后发性白内障、糖尿病性视网膜病变、增生性玻璃体视网膜病变、眼部肿瘤等。其中有报道[11]表明LncRNA PAUPAR通过调控组蛋白H3K4的去甲基化进而抑制葡萄膜黑色素瘤的发生。作者的前期研究[12-13]提示,在人晶状体上皮细胞株SRA01/04中,高浓度短时间的氧化损伤可诱导氧化损伤模型,而低浓度长时间的氧化损伤可诱导衰老模型。ARC的衰老发病机制与氧化损伤机制紧密相扣,氧化损伤相关的表观遗传学改变与ARC密切相关[14]。因此,衰老相关LncRNA可能通过参与表观遗传学调控影响细胞衰老,进而引起ARC。
本研究初步阐明了LncRNA PINT可能通过p53/p21通路调控相关基因的表观遗传改变,参与ARC的发生发展,揭示了衰老相关LncRNA在ARC发病机制中起到重要作用,可作为ARC防治的新靶点。本研究从表观遗传学水平探讨ARC发病机制,为ARC防治提供新思路,有助于研发抗ARC药物,为进一步深入了解白内障的发病机理提供了理论基础和方向。
共同第一作者: 朱晓宇 -
[1] KHAIRALLAH M, KAHLOUN R, BOURNE R, et al. Number of people blind or visually impaired by cataract worldwide and in world regions, 1990 to 2010[J]. Invest Ophthalmol Vis Sci, 2015, 56(11): 6762-6769. doi: 10.1167/iovs.15-17201
[2] ZHAO J L, ELLWEIN L B, CUI H, et al. Prevalence of vision impairment in older adults in rural China: the China Nine-Province Survey[J]. Ophthalmology, 2010, 117(3): 409-416, 416. doi: 10.1016/j.ophtha.2009.11.023
[3] KUNG J T, COLOGNORI D, LEE J T. Long noncoding RNAs: past, present, and future[J]. Genetics, 2013, 193(3): 651-669. doi: 10.1534/genetics.112.146704
[4] 杨德英, 朱晨星, 杨明耀. lncRNA在细胞衰老中的作用[J]. 中国生物化学与分子生物学报, 2016, 32(2): 140-146. https://www.cnki.com.cn/Article/CJFDTOTAL-SWHZ201602004.htm [5] GRAMMATIKAKIS I, PANDA A C, ABDELMOHSEN K, et al. Long noncoding RNAs(lncRNAs) and the molecular hallmarks of aging[J]. Aging (Albany NY), 2014, 6(12): 992-1009. http://europepmc.org/abstract/med/25543668
[6] 李渤. GSTM3基因的表达及表观遗传学改变与年龄相关性白内障的关系[D]. 南通: 南通大学, 2016. [7] MARÍN-BÉJAR O, MARCHESE F P, ATHIE A, et al. Pint lincRNA connects the p53 pathway with epigenetic silencing by the Polycomb repressive complex 2[J]. Genome Biol, 2013, 14(9): R104. doi: 10.1186/gb-2013-14-9-r104
[8] ONO A, ITO A, SUZUKI T, et al. DNA damage-responsive transgene expression mediated by the p53 promoter with transcriptional amplification[J]. J Biosci Bioeng, 2015, 120(4): 463-466. doi: 10.1016/j.jbiosc.2015.02.009
[9] LI F, WEN X Y, ZHANG H, et al. Novel insights into the role of long noncoding RNA in ocular diseases[J]. Int J Mol Sci, 2016, 17(4): 478-478. doi: 10.3390/ijms17040478
[10] SHEN Y, DONG L F, ZHOU R M, et al. Role of long non-coding RNA MIAT in proliferation, apoptosis and migration of lens epithelial cells: a clinical and in vitro study[J]. J Cell Mol Med, 2016, 20(3): 537-548. doi: 10.1111/jcmm.12755
[11] DING X, WANG X, LIN M, et al. PAUPAR lncRNA suppresses tumourigenesis by H3K4 demethylation in uveal melanoma[J]. FEBS Lett, 2016, 590(12): 1729-1738. doi: 10.1002/1873-3468.12220
[12] ZHANG Z F, ZHANG J, HUI Y N, et al. Up-regulation of NDRG2 in senescent lens epithelial cells contributes to age-related cataract in human[J]. PLoS One, 2011, 6(10): e26102. doi: 10.1371/journal.pone.0026102
[13] DUAN J M, DUAN J P, ZHANG Z Y, et al. Irreversible cellular senescence induced by prolonged exposure to H2O2 involves DNA-damage-and-repair genes and telomere shortening[J]. Int J Biochem Cell Biol, 2005, 37(7): 1407-1420. doi: 10.1016/j.biocel.2005.01.010
[14] LI B, ZHOU J, ZHANG G W, et al. Relationship between the altered expression and epigenetics of GSTM3 and age-related cataract[J]. Invest Ophthalmol Vis Sci, 2016, 57(11): 4721-4732. doi: 10.1167/iovs.16-19242




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
