Inhibitory effect of astaxanthin on autophagy and apoptosis of AGS cell infected by Helicobacter pylori
-
摘要:目的 探讨虾青素对幽门螺杆菌(Hp)感染AGS细胞自噬和凋亡的影响。方法 选取胃上皮细胞株AGS细胞进行Hp感染,根据虾青素的浓度分为对照组[二甲基亚砜(DMSO)处理]、10 μmol/L组、20 μmol/L组、50 μmol/L组。分组处理96 h后,采用免疫荧光标记检测细胞Hp外膜蛋白(OMP)表达,实时荧光定量PCR(qRT-PCR)检测相关基因微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)、LC3-Ⅰ、Beclin1、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)mRNA表达,Western blot法检测细胞自噬和凋亡相关蛋白的表达,TUNEL法检测细胞凋亡情况。结果 Hp在AGS细胞质中弥散分布,Hp感染AGS细胞成功。虾青素可抑制Hp的增殖,10、20、50 μmol/L组细胞凋亡率均低于对照组,差异有统计学意义(P < 0.05)。Beclin1、LC3-Ⅱ与LC3-Ⅰ比值(LC3-Ⅱ/LC3-Ⅰ)、Bax蛋白及mRNA的表达随着虾青素浓度的增高而逐渐降低,Bcl-2蛋白及mRNA表达随着虾青素浓度的增高而逐渐升高,与对照组相比,差异有统计学意义(P < 0.01)。虾青素10、20、50 μmol/L组白细胞介素-17(IL-17)含量均低于对照组,差异有统计学意义(P < 0.05),且随着虾青素浓度的增高,IL-17含量逐渐下降。结论 随着虾青素浓度的增高,Hp感染的AGS细胞的自噬及凋亡能力减弱。Abstract:Objective To investigate the effect of astaxanthin on autophagy and apoptosis of AGS cell infected by Helicobacter pylori (Hp).Methods The AGS cells of gastric epithelial cell line were infected by Hp. The infected cells were divided into control group[processed by dimethyl sulfoxide (DMSO)], 10 μmol/L astaxanthin group, 20 μmol/L astaxanthin group and 50 μmol/L astaxanthin group. After 96 hours of grouping, expression of outer membrane protein (OMP) of Hp of cells was detected by immunofluorescence. The mRNA expressions of microtubule associated protein 1 light chain 3-Ⅱ (LC3-Ⅱ), LC3-Ⅰ, Beclin1, B-cell lymphoma/leukemia-2 (Bcl-2) and Bcl-2 related X protein (Bax) were detected by quantitative real-time PCR (qRT-PCR). The expressions of autophagy and apoptosis related proteins were detected by Western blot, and apoptosis was detected by TUNEL.Results Hp was dispersed in AGS cytoplasm, and Hp was able to infect AGS cells successfully. Astaxanthin was able to inhibit the proliferation of Hp, and the apoptosis rates of 10, 20 and 50 μmol/L groups were significantly lower than those of the control group (P < 0.05). The protein and gene expressions of Beclin1, ratio of LC3-Ⅱ to LC3-Ⅰ (LC3-Ⅱ/LC3-Ⅰ) and Bax protein decreased gradually with the increase of astaxanthin concentration, while protein and gene expressions of Bcl-2 protein increased gradually with the increase of astaxanthin concentration, and there were significant differences when compared to control group (P < 0.01). The contents of interleukin-17 (IL-17) in 10, 20 and 50 μmol/L astaxanthin groups were significantly lower than that in the control group (P < 0.05), and the content of IL-17 decreased gradually with the increase of astaxanthin concentration.Conclusion With the increase of astaxanthin concentration, the autophagy and apoptosis of AGS cells infected by Hp decrease.
-
Keywords:
- astaxanthin /
- Helicobacter pylori /
- gastric epithelial cell line /
- autophagy /
- apoptosis
-
幽门螺杆菌(Hp)是定植于胃黏膜的一种革兰氏阴性杆菌,与胃炎、胃溃疡的关系密切,研究[1]发现其与胃癌有关,是导致胃黏膜癌变的主要原因。自噬是维持细胞稳定的重要方式,在介导机体免疫应答、炎症反应、细胞正常生长和分化、细胞损伤和修复等病理生理活动中发挥重要的作用,但过度自噬会对细胞造成损害[2]。研究[3]表明, Hp可通过自噬途径损伤胃黏膜,诱导慢性炎症,进而导致癌变。凋亡是细胞在相关基因的调控下发生的正常死亡过程。研究[4]表明, Hp VacA可影响细胞线粒体膜点位,诱导细胞凋亡。研究[5]发现, Hp(+)胃黏膜细胞的凋亡发生率明显高于Hp(-)细胞。虾青素是天然存在的类胡萝卜素,具有抗氧化、抗炎症和抗肿瘤等功效,已成为研究的热点。马于林等[6]研究发现,虾青素可通过抑制氧化应激来抑制细胞凋亡。本研究通过构建Hp感染的胃上皮细胞株AGS细胞,加入不同浓度的虾青素,观察细胞自噬及凋亡的情况,现将结果报告如下。
1. 材料与方法
1.1 主要试剂、细胞株及仪器
人胃上皮细胞株AGS细胞(上海生命科学研究所); 虾青素(纯度>98%,长沙上禾生物科技有限公司); Hp标准株NCTC11637、SS1(中国疾病预防控制中心传染病预防控制所); Ham′s F12培养液、哥伦比亚琼脂培养基(Sigma公司,美国); 胎牛血清、双抗、胰蛋白酶(Biosciences, 美国); 兔抗人微管相关蛋白1轻链3-Ⅱ(LC3-Ⅱ)、LC3-Ⅰ、Beclin1、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-actin多克隆一抗、鼠抗兔单克隆二抗、FITC标记鼠抗兔抗体(Sigma公司,美国); Trizol试剂(江苏碧云天科技有限公司); LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax及DADPH引物序列(上海生工有限公司); RNA提取试剂盒、PCR试剂盒(武汉博士德生物公司); 白细胞介素-17(IL-17)酶联免疫检测试剂盒(南京奥尼多福公司); TUNEL原位凋亡细胞检测试剂盒、DAPI染色试剂盒(BioVision公司,美国); 酶标仪、倒置荧光显微镜(上海仪电分析仪器有限公司); ABI 7900PCR扩增仪(上海仪电分析仪器有限公司); Trans Blot转膜仪、化学发光成像仪(上海仪电分析仪器有限公司); 凝胶成像系统(UVP bioimaging systems,美国)。
1.2 细胞、Hp培养
含10%胎牛血清(FBS)和青霉素、链霉素各100 U/L的Ham′s F12培养基培养AGS细胞,培养条件为37 ℃、5% CO2。待细胞铺满培养瓶后,用0.25%胰酶消化,制备单细胞悬液,使用血清培养基继续培养,定期更换培养基、传代。
吸取50 μL Hp菌种,均匀接种到哥伦比亚琼脂培养基中,放入37 ℃下10%CO2、5%O2、85%N2培养箱中培养96 h。
1.3 抑菌试验
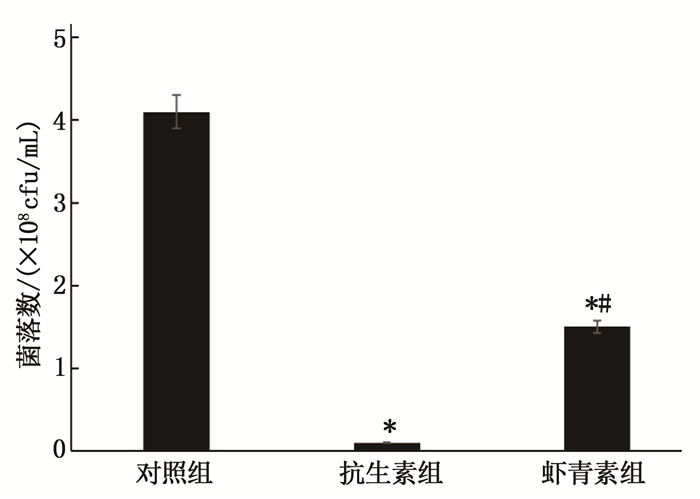
用培养液配成10 μmol/L的虾青素。在24孔板中加入10 μL Hp菌悬液(109 cfu/mL)以及990 μL虾青素,空白对照组加入不含药物的培养液[含0.1%二甲基亚砜(DMSO)、10%FBS的培养液]和菌悬液,阳性对照组则加入含100 μg/mL阿莫西林和50 μg/mL克拉霉素混合抗生素的培养液和Hp菌悬液。37 ℃微需氧条件下培养24 h后,适当稀释,取50 μL转至哥伦比亚血琼脂培养基上,培养48 h后计数菌落。
1.4 Hp感染AGS细胞的方法及分组
选取第3代细胞, 0.25%胰酶消化,调整浓度为1×106/L的单细胞悬液,接种于6孔板,每组设置5个复孔。Hp菌种培养24 h后,测定细菌浓度,更换新鲜培养基,并按照Hp菌落: 细胞数=100∶1加入Hp菌悬液, 37 ℃、5% CO2共培养。更换培养液,保证每孔中培养液为2.0 mL, 将不同浓度的虾青素0.5 mL加入到6孔板中,对照组(虾青素0 μmol/L, DMSO代替), 10 μmol/L组(虾青素10 μmol/L), 20 μmol/L组(虾青素20 μmol/L), 50 μmol/L组(虾青素50 μmol/L)。细胞继续培养96 h, 用于后续实验。
1.5 免疫荧光检测Hp感染AGS细胞
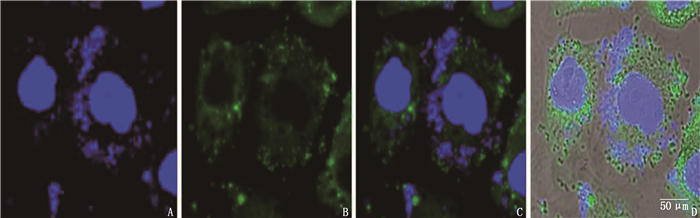
取Hp感染的AGS细胞,去培养液, PBS冲洗, 3%多聚甲醛孵育10 min, PBS洗涤,用1%牛血清白蛋白(BSA)、22.52 mg/mL甘氨酸的磷酸盐吐温缓冲液(PBST)孵育细胞30 min以封闭抗体, PBS洗涤,加入外膜蛋白(OMP)单克隆一抗孵育4 ℃室温过夜, PBS洗涤,与相应荧光标记二抗反应, PBS洗涤,加入DAPI, 37 ℃孵育15 min, 弃染色液,甲醇洗涤; 加入甘油,激光共聚焦显微镜下观察。
1.6 实时荧光定量PCR (qRT-PCR)检测细胞LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax mRNA表达
对数生长期的细胞,胰酶消化,离心。加入等体积TRIzol试剂,根据试剂盒说明书提取总RNA, 溶于20 μL二乙基焦碳酸酯(DEPC)水,取1 μL加入79 μL DEPC水检测纯度。根据反转录试剂盒合成cDNA,样品总RNA 1 μg, 随机引物或oligo(dT)18-20为100 pmol, 脱氧核苷三磷酸(每种dNTP各10 mmol/L) 1 μL, 反转录缓冲液(5×) 4 μL, RNase抑制剂(20~40 U/μL) 1 μL, M-MLV反转录酶20 U, DEPC处理水补至20 μL, 目标引物序列见表 1。根据试剂盒说明书进行PCR扩增: cDNA 2 μL, 上、下引物各3 μL, Taq聚合酶0.5 μL, 总体积共25 μL, 反应参数设置为92 ℃ 20 s、96 ℃ 2 s、85 ℃ 20 s、80 ℃ 6 s, 共40个循环。构建溶解曲线。采用2-△△Ct法计算目标引物mRNA的相对表达量。引物序列见表 1。
表 1 引物序列引物名称 序列 LC3-Ⅱ 上游 5′-AAGCAACTCTGGATGGGATT-3′ 下游 5′-GCAGCCACAGGACGA AAC-3′ LC3-Ⅰ 上游 5′-GGAAGAGCACCGUGAUCAAdTdT-3′ 下游 5′-AACACGCCCGUGCCCAUGAACdTdT-3′ Beclin 1 上游 5′-AGCATTCCGTCTGACCATCA-3′ 下游 5′-ACTCAGACCCTGAGGCTCAAAG-3′ Bcl-2 上游 5′-GATACGAAGGGAGGGTGTACCA-3′ 下游 5′-CTCGGCCAGGGTGTTGAA-3′ Bax 上游 5′-CTGAAATTTATTGACAAACAGC-3′ 下游 5′-GCATCGAGAGAAGAGCAGGGACAT-3′ GAPDH 上游 5′-GCAAATTCCATGGCACCGT-3′ 下游 5′-TCGCCCCACTTGATTTTGG-3′ 1.7 Western blot法检测LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax蛋白的表达
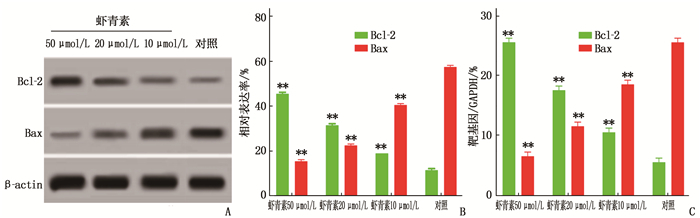
细胞经胰酶消化, 40 ℃下1 500转/min离心5 min, 去上清,超声波破核,离心,取上清液。配胶、上样、电泳、转膜、切膜,封闭液封闭1 h, 逐次LC3-Ⅱ(1∶500)、LC3-Ⅰ(1∶500)、Beclin1(1∶500)、Bcl-2(1∶100)、Bax(1∶100)、辣根过氧化物酶标记的二抗(1∶100)。Bio-Rad成像仪曝光成像, Image Lab Software测定光密度,以目标蛋白与β-actin条带光密度值比值表示相对表达量。
1.8 TUNEL实验及ELISA检测IL-17浓度
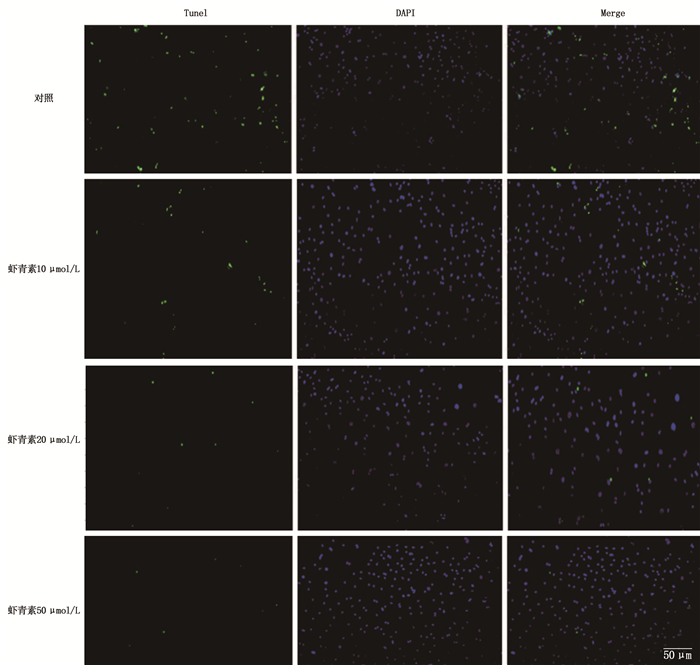
取Hp感染的AGS细胞,去除培养液, PBS冲洗, 3%多聚甲醛孵育10 min, PBS洗涤,加入适量凋亡检测液, 37 ℃孵育60 min, PBS洗涤,加入DAPI室温避光孵育8 min, PBS冲洗,加抗淬灭剂,激光共聚焦显微镜下观察,计算凋亡率。细胞核呈蓝色,凋亡细胞呈绿色。
取各组AGS细胞, 3 000转/min离心10 min, 收集细胞上清, ELISA检测IL-17浓度。具体操作步骤严格按照说明书进行。
1.9 统计学分析
本研究采用SPSS 17.0软件处理数据,计量资料采用(x±s)表示,组间均数的比较釆用独立样本t检验,多组间均数的比较采用方差分析,假定方差齐性采用LDS检验,假定方差不齐性釆用Dunnett′s T3检验。计数资料使用%表示,组间比较行χ2检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 Hp感染AGS细胞
Hp在AGS细胞质中弥散分布,进行自我复制,提示Hp感染AGS细胞成功,并在细胞内增殖。见图 1。
2.2 虾青素对Hp增殖的影响
与对照组比较,虾青素对Hp增殖起到显著的抑制作用(P < 0.05), 但弱于抗生素组,差异有统计学意义(P < 0.05)。见图 2。
2.3 虾青素对Hp感染AGS细胞凋亡的抑制作用
虾青素10 μmol/L组细胞凋亡率为(1.11±0.03)%, 20 μmol/L组为(0.35±0.04)%, 50 μmol/L组为(0.22±0.03)%, 均低于对照组的(2.14±0.04)%, 差异有统计学意义(P < 0.01)。随着虾青素浓度的增高,细胞凋亡率逐渐下降,提示虾青素对Hp感染AGS细胞凋亡的抑制作用具有浓度依赖性。见图 3、4。
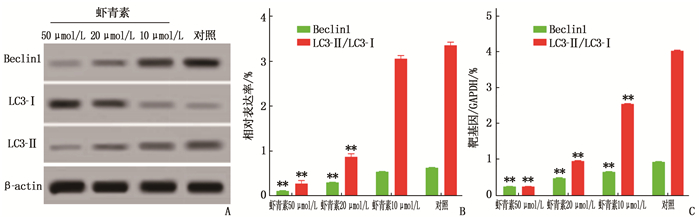
2.4 虾青素对Hp感染AGS细胞LC3-Ⅱ、LC3-Ⅰ、Beclin1、Bcl-2、Bax蛋白及mRNA的影响
虾青素10、20、50 μmol/L组细胞Bcl-2蛋白表达量高于对照组,差异有统计学意义(P < 0.01), 且随着浓度的增高,表达量逐渐升高。虾青素10、20、50 μmol/L组细胞Beclin1、LC3-Ⅱ与LC3-Ⅰ比值(LC3-Ⅱ/LC3-Ⅰ)、Bax表达低于对照组,差异有统计学意义(P < 0.01), 且随着浓度的增高,表达量逐渐下降。
虾青素10、20、50 μmol/L组细胞Bcl-2 mRNA表达量高于对照组,差异有统计学意义(P < 0.01), 且随着浓度的增高,表达量逐渐升高。虾青素10、20、50 μmol/L组细胞Beclin1、LC3-Ⅱ/LC3-Ⅰ、Bax mRNA表达低于对照组,差异有统计学意义(P < 0.01), 且随着浓度的增高,表达量逐渐下降。见图 5、6。
2.5 虾青素对Hp感染AGS细胞IL-17的影响
虾青素10、20、50 μmol/L组IL-17含量依次为(102.12±21.92)、(91.02±11.23)、(72.23±12.34) pg/mL, 均低于对照组的(123.84±14.39) pg/mL, 差异有统计学意义(P < 0.05), 且随着浓度的增高, IL-17含量逐渐下降,提示虾青素对Hp感染AGS细胞的炎症抑制作用具有浓度依赖性。
3. 讨论
近年来,随着生物化学及提纯分离方法的进步,越来越多的天然药物获得分离,虾青素属于类胡萝卜素化合物,具有抗炎、抗肿瘤、抗凋亡等功效[7-10]。研究结果[11]显示,虾青素可激活过氧化物酶增殖物激活受体-γ(PPAR-γ)及其下游靶基因过氧化氢酶,减轻Hp感染AGS细胞的氧化应激及炎症反应。凋亡和自噬是细胞死亡的2种途径,但存在密不可分、相互作用的关系,在肿瘤发生、发展中起关键作用[12]。
自噬是真核细胞维持细胞稳定、提供能量的过程,人体多种疾病与自噬相关。研究[13]发现,自噬在胃黏膜细胞Hp感染导致癌变的发生、发展中发挥重要的作用。自噬过程受到多种因子调控,其中自噬相关蛋白在自噬过程中发挥不可替代的作用。Beclin1蛋白是启动自噬的重要蛋白,与PI3K形成结合体,调控Atg蛋白的位置,进而加速自噬体的形成[14]。研究[15]发现,胃癌组织中Hp感染与Beclin1表达有关,提示Hp可能通过自噬参与了胃癌的发生、发展。LC3位于自噬泡膜,参与自噬体的合成,与自噬泡的数量呈正相关。LC3主要包括Ⅰ型和Ⅱ型, LC3-Ⅰ代表了自噬前状态,发生自噬后, LC3-Ⅰ与自噬泡膜的PE结合形成LC3-Ⅱ[16]。LC3-Ⅱ、LC3-Ⅰ及Beclin1是与自噬密切相关的蛋白,在自噬体形成中发挥至关重要的作用,可反映自噬活动,是研究自噬活动的特异性指标[17]。本研究结果显示,加入虾青素后Hp感染AGS细胞Beclin1蛋白及mRNA表达量, LC3-Ⅱ/LC3-Ⅰ均降低,提示虾青素抑制了细胞的自噬过程。Hp介导的细胞自噬机制复杂,目前认为与活性氧、炎症因子的释放密切相关,虾青素作为一种天然化合物,具有抗炎、抗氧化的作用,因而可以有效抑制自噬过程。
细胞凋亡是细胞在一系列基因激活下进行的一种死亡过程,通过这种过程,人体可消除无功能或异常细胞。Hp感染细胞后,会诱发细胞启动凋亡过程以清除被感染的细胞。TUNEL染色是最常用的一种凋亡研究方法,主要是通过特定的染料标记凋亡细胞,从而区分凋亡、正常细胞[18]。本研究结果显示,虾青素能显著降低Hp感染后AGS细胞TUNEL的阳性表达率。Bcl-2家族是调控细胞凋亡的关键蛋白,主要包括抗凋亡蛋白(Bcl-2)和促凋亡蛋白(Bax)。Bcl-2通过结合Bax蛋白,形成二聚体,使Bax蛋白处于失活状态,导致细胞不能启动凋亡途径[19]。当Bcl-2表达被抑制后,则与Bax分离,引起凋亡的发生。雷艳杰等[20]研究发现,胃癌组织中Bcl-2蛋白高表达,其含量与Hp感染呈正相关。蒋漫琦等[21]研究结果表明, Bcl-2蛋白在Hp感染的慢性萎缩性胃炎组织中高表达。本研究结果显示,加入虾青素后, Bcl-2蛋白含量增加, Bax蛋白含量降低,且抑制作用具有浓度依赖性,进一步说明了虾青素可抑制Hp感染后AGS细胞的凋亡,且浓度越高,这种抑制性越强。岳亮等[22]研究结果显示,虾青素可通过调控Wnt/β-catenin信号通路促进胶质瘤细胞凋亡。Hp感染细胞过程中会发生氧化应激反应,产生大量的自由基,而虾青素具有抗氧化、清除自由基的功效,因而可以抑制细胞的凋亡过程。
IL-17是重要的促炎性细胞因子,其可诱导多种细胞释放炎症介质, IL-17不仅与炎性反应密切相关,还与消化道恶性肿瘤等相关[23]。研究[24]表明, IL-17广泛存在于乳腺癌、肝癌及胃癌等多种肿瘤中。IL-17具有促进肿瘤发生、发展的作用,同时肿瘤所处的微环境可直接诱导IL-17细胞因子。本研究结果显示,加入虾青素后IL-17含量降低,且抑制作用具有浓度依赖性,进一步说明了虾青素可抑制Hp感染后炎症反应,且浓度越高,这种抑制性越强。
综上所述,虾青素可抑制Hp感染后AGS细胞的凋亡及自噬过程,具有浓度依赖性,为Hp的治疗及胃癌的防治提供了新的思路。但本研究只是初步研究,具体机制有待深入、全面的探索。
-
表 1 引物序列
引物名称 序列 LC3-Ⅱ 上游 5′-AAGCAACTCTGGATGGGATT-3′ 下游 5′-GCAGCCACAGGACGA AAC-3′ LC3-Ⅰ 上游 5′-GGAAGAGCACCGUGAUCAAdTdT-3′ 下游 5′-AACACGCCCGUGCCCAUGAACdTdT-3′ Beclin 1 上游 5′-AGCATTCCGTCTGACCATCA-3′ 下游 5′-ACTCAGACCCTGAGGCTCAAAG-3′ Bcl-2 上游 5′-GATACGAAGGGAGGGTGTACCA-3′ 下游 5′-CTCGGCCAGGGTGTTGAA-3′ Bax 上游 5′-CTGAAATTTATTGACAAACAGC-3′ 下游 5′-GCATCGAGAGAAGAGCAGGGACAT-3′ GAPDH 上游 5′-GCAAATTCCATGGCACCGT-3′ 下游 5′-TCGCCCCACTTGATTTTGG-3′ -
[1] 马钰, 刘屹, 普彦淞, 等. P504S、Ki-67对老年胃癌的早期诊断价值及与幽门螺旋杆菌的相关性研究[J]. 现代肿瘤医学, 2020, 28(19): 3382-3386. doi: 10.3969/j.issn.1672-4992.2020.19.023 [2] 马玉梅, 王亚平, 马颖才. 自噬在胃癌中作用的研究进展[J]. 癌症进展, 2018, 16(14): 1695-1698. [3] 黄李冰雪, 张涛, 钟婵, 等. 自噬介导幽门螺杆菌感染相关胃癌信号通路的研究进展[J]. 医学综述, 2019, 25(17): 3394-3399. doi: 10.3969/j.issn.1006-2084.2019.17.013 [4] 周婵萍, 张普, 孔丽敏, 等. Hp感染诱导胃黏膜上皮细胞凋亡与IFN-γ、IL-4蛋白表达的关系[J]. 中华医院感染学杂志, 2017, 27(23): 5305-5307, 5311. [5] 刘加霏, 国东, 褚衍六, 等. 幽门螺杆菌急性感染对胃上皮细胞凋亡的影响[J]. 中国微生态学杂志, 2020, 32(8): 880-883. [6] 马于林, 李亚, 彭媛媛, 等. 虾青素对氧化应激下平滑肌细胞自噬与凋亡的影响[J]. 武汉大学学报: 医学版, 2020, 41(2): 193-198. [7] ZHANG L T, SU F, ZHANG C H, et al. Changes of photosynthetic behaviors and photoprotection during cell transformation and astaxanthin accumulation in Haematococcus pluvialis grown outdoors in tubular photobioreactors[J]. Int J Mol Sci, 2016, 18(1): 33-39. doi: 10.3390/ijms18010033
[8] GALASSO C, OREFICE I, PELLONE P, et al. On the neuroprotective role of astaxanthin: new perspectives?[J]. Mar Drugs, 2018, 16(8): E247-E257. doi: 10.3390/md16080247
[9] MULARCZYK M, MICHALAK I, MARYCZ K. Astaxanthin and other Nutrients from Haematococcus pluvialis-Multifunctional Applications[J]. Mar Drugs, 2020, 18(9): E459-E468. doi: 10.3390/md18090459
[10] WONG S K, IMA-NIRWANA S, CHIN K Y. Effects of astaxanthin on the protection of muscle health (Review)[J]. Exp Ther Med, 2020, 20(4): 2941-2952. http://www.researchgate.net/publication/343293276_Effects_of_astaxanthin_on_the_protection_of_muscle_health_Review
[11] KIM S H, LIM J W, KIM H. Astaxanthin inhibits mitochondrial dysfunction and interleukin-8 expression in Helicobacter pylori-infected gastric epithelial cells[J]. Nutrients, 2018, 10(9): E1320-E1328. doi: 10.3390/nu10091320
[12] KIM S H, KIM H. Astaxanthin modulation of signaling pathways that regulate autophagy[J]. Mar Drugs, 2019, 17(10): E546-E553. doi: 10.3390/md17100546
[13] TSUJI S, NAKAMURA S, MAOKA T, et al. Antitumour effects of astaxanthin and adonixanthin on glioblastoma[J]. Mar Drugs, 2020, 18(9): E474-E484. doi: 10.3390/md18090474
[14] LV Y, FANG L, DING P S, et al. PI3K/Akt-Beclin1 signaling pathway positively regulates phagocytosis and negatively mediates NF-κB-dependent inflammation in Staphylococcus aureus-infected macrophages[J]. Biochem Biophys Res Commun, 2019, 510(2): 284-289. doi: 10.1016/j.bbrc.2019.01.091
[15] 张海云, 蔡晓波, 郭宝明, 等. 胃癌患者Hp感染与CyclinD1、NF-kb、Beclin1表达及临床病理特征的关系分析[J]. 中国实验诊断学, 2020, 24(5): 773-776. doi: 10.3969/j.issn.1007-4287.2020.05.016 [16] RUNWAL G, STAMATAKOU E, SIDDIQI F H, et al. LC3-positive structures are prominent in autophagy-deficient cells[J]. Sci Rep, 2019, 9(1): 10147-10156. doi: 10.1038/s41598-019-46657-z
[17] LI C X, CHEN Q L, TIAN Z Q, et al. Expression of MIF, Beclin1, and LC3 in human salivary gland adenoid cystic carcinoma and its prognostic value[J]. Medicine (Baltimore), 2019, 98(20): e15402-e15409. doi: 10.1097/MD.0000000000015402
[18] LIU S H, ZHANG Z Y, ZHOU S W, et al. An electrochemical-TUNEL method for sensitive detection of apoptotic cells[J]. Analyst, 2016, 141(2): 567-569. doi: 10.1039/C5AN01780G
[19] FREEDMAN A, JACOBSEN E. Follicular lymphoma: 2020 update on diagnosis and management[J]. Am J Hematol, 2020, 95(3): 316-327. doi: 10.1002/ajh.25696
[20] 雷艳杰, 卜晓红. FHIT蛋白、Bcl-2蛋白、p53蛋白在胃癌中的表达及其与幽门螺旋杆菌感染的相关性[J]. 实用癌症杂志, 2020, 35(6): 903-906. doi: 10.3969/j.issn.1001-5930.2020.06.010 [21] 蒋漫琦, 张永宏. PCNA、Bcl-2蛋白在幽门螺杆菌感染的慢性萎缩性胃炎中的表达[J]. 中国中西医结合消化杂志, 2016, 24(9): 693-694. [22] 岳亮, 朱敏, 卢毅, 等. 不同浓度的虾青素对胶质瘤细胞活力和细胞凋亡的影响及其分子机制研究[J]. 中国临床药理学杂志, 2020, 36(4): 428-432. [23] TANAKA S, NAGASHIMA H, CRUZ M, et al. Interleukin-17C in human Helicobacter pylori gastritis[J]. Infect Immun, 2017, 85(10): e00389-e00317. http://www.ncbi.nlm.nih.gov/pubmed/28739826
[24] NALBANT A. IL-17, IL-21, and IL-22 cytokines of T helper 17 cells in cancer[J]. J Interferon Cytokine Res, 2019, 39(1): 56-60. doi: 10.1089/jir.2018.0057




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号