Up-regulated expression of synaptophysin by simvastatin through activation of MEK/ERK signaling pathways
-
摘要:目的 研究辛伐他汀(SV)对体外培养大鼠大脑皮层神经元突触素(SYP)的影响及信号转导机制。方法 从新生Sprague-Dawley大鼠大脑皮层分离和培养神经元, 4 d后分为对照组、SV处理组(2、4、8 μmol/L作用48 h)、PD98059处理组和SV+PD98059处理组(先加入10 μmol/L阻断剂PD98059作用30 min, 再加入10 μmol/L SV作用48 h)。应用免疫荧光检测法检测SYP表达, Western blot检测磷酸化丝裂原细胞外激酶(p-MEK)、磷酸化细胞外调节蛋白激酶1(p-ERK1)和磷酸化细胞外调节蛋白激酶2(p-ERK2)水平。结果 免疫荧光检测显示, 4 μmol/L SV可明显增强SYP免疫反应性。Western blot检测显示, 8 μmol/L SV可显著增高SYP、p-MEK、p-ERK1和p-ERK2水平。应用PD98059可显著降低SV引起的SYP、p-MEK、p-ERK1和p-ERK2水平上调。结论 SV可通过激活MEK/ERK信号转导通路上调SYP表达。Abstract:Objective To investigate the effect of simvastatin (SV) on the expression of synaptophysin (SYP) in cerebral cortex of cultured rats in vitro and its signal transduction mechanism.Methods Neurons were isolated and cultured from cerebral cortex of neonatal Sprague Dawley rats. After 4 days, the rats were divided into control group, SV group (processed with 2, 4, 8 μmol/L SV for 48 h), PD98059 treatment group, and SV combined with PD98059 treatment group (firstly processed with 10 μmol/L blocker PD98059 for 30 min, and then treated with 10 μmol/L SV for 48 h). The expression of SYP was detected by immunofluorescence assay, and the levels of phosphorylated mitogen-activated protein kinase (p-MEK), phosphorylated extracellular regulated protein kinase 1 (p-ERK1) and phosphorylated extracellular regulated protein kinase 2 (p-ERK2) were detected by Western blot.Results Immunofluorescence assay showed that 4 μmol/L SV could significantly enhance the immunoreactivity of SYP. Western blot showed that 8 μmol/L SV could significantly increase the levels of SYP, p-MEK, p-ERK1 and p-ERK2. PD98059 can significantly reduce up-regulation of SYP, p-MEK, p-ERK1 and p-ERK2 induced by SV.Conclusion SV can up-regulate SYP expression by activating MEK/ERK signal transduction pathway.
-
Keywords:
- simvastatin /
- synaptophysin /
- neurons /
- extracellular regulated protein kinase
-
神经元回路受损与神经元结构、功能的改变密切相关,受损的神经元回路会导致一系列神经发育性疾病。突触素(SYP)作为突触前膜的特异性标志蛋白,能够参与突触发生、突触囊泡转运并介导突触信号,对神经递质的释放过程也起到积极的调节作用,对保持神经元的正常生理功能具有重要的意义[1]。1986年, COULOMBE P等[2]提出的经典信号通路丝裂原活化蛋白激酶-细胞外调节蛋白激酶(MAPK-ERK)途径,其主要调节、控制细胞多种生理反应,对学习记忆功能有重要的调控作用。细胞外调节蛋白激酶(ERK)通路主要途径包括Ras/Raf/MEK/ERK, 丝裂原活化蛋白激酶(MEK)是ERK上游的关键蛋白,其主要作用之一是磷酸化激活其下游底物ERK。MEK/ERK这条经典的信号转导通路在细胞的生长、发育、分化等方面发挥着十分重要的作用,例如神经元突起的形成及发育,包括树突、轴突以及神经元极性的形成等[3-4]。ERK被激活后能够参与维持神经元树枝状及其形态[5]。有关大鼠皮层神经细胞的实验[6-7]发现,激活MEK/ERK信号通路能够促进缺氧损伤的大鼠神经细胞存活。辛伐他汀[8-10](SV)是羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,具有较好的调节血脂的作用,并具有神经保护功能。本实验采用体外培养新生乳鼠大脑皮层神经元,观察SV对SYP表达的影响,分析SV对神经元SYP促进作用的信号传导机制,现将结果报告如下。
1. 材料与方法
1.1 主要试剂
SV购自杭州默沙东制药有限公司,批号N1001; 新生胎牛血清、马血清购自杭州四季青工程材料有限公司; DMEM、F12培养基购自Invitrogen公司; 胰蛋白酶、L-多聚赖氨酸、二甲基亚砜(DMSO)均购自Sigma公司; 阿糖胞苷为意大利S.P.A公司产品; MEK/ERK阻断剂PD98059和磷酸化MEK(p-MEK)、磷酸化ERK1(p-ERK1)和磷酸化ERK2(p-ERK2)鼠属单克隆抗体购自CELL Signaling公司; 鼠SYP单克隆抗体购自Santa Cruz公司; 山羊抗小鼠IgG二抗、HRP辣根过氧化物酶标记购自Abbkine。
1.2 皮层神经元培养
将出生24 h内的新生大鼠置于75%酒精浸泡消毒,在无菌条件下取大脑皮层放入盛有F12的培养基中剥离脑膜,用PBS冲洗1遍。将大脑皮层剪碎为1 mm3的组织块,加入0.125%胰蛋白酶在37 ℃消化10 min。消化后的细胞呈离散状,加入10%胎牛血清2~3滴停止消化。200目筛网过滤, 1 000×g离心10 min, 去上清。将一定量的10%马血清、10%胎牛血清、F12、DMEM配制成细胞悬液,调整细胞密度为(1×105~1×106)/mL, 接种于培养板中,置入37 ℃、5%CO2孵箱中培养。细胞培养2 d后,加入一定浓度的阿糖胞苷以抑制胶质细胞增殖,重新更换培养基。此后每3 d半量换液1次,细胞培养4 d后用于实验。应用兔抗神经元特异性稀醇化酶(NSE)和NF200抗体进行免疫荧光染色鉴定,结果显示神经元培养纯度在90%以上。
1.3 细胞分组及处理
实验分为对照组、不同浓度SV处理组、PD98059处理组、SV+PD98059处理组。对照组: 加入等量培养基; SV处理组: 培养4 d的神经元分别加入不同浓度(2、4、8 μmol/L)SV作用48 h; PD98059处理组: 培养4 d的神经元加入10 μmol/L阻断剂PD98059作用48 h; SV+PD98059处理组: 先加入10 μmol/L阻断剂PD98059作用30 min, 再加入10 μmol/L SV共同作用48 h。
1.4 SYP免疫荧光染色
细胞培养7 d后弃掉培养基, PBS清洗3次; 室温下用新配制的4%多聚甲醛固定25 min, PBS清洗3次; 室温下浸入含0.1% Triton X-100的PBS中通透30 min, PBS清洗2次; 采用含0.1% BSA的PBS于室温下封闭60 min; 加入SYP抗体(1∶100) 4 ℃过夜。室温放置60 min, PBS冲洗3次; 加入红棕色罗丹明溶液标记的二抗(1∶100)室温作用60 min, 避光PBS冲洗3次; 50%甘油封片。倒置荧光显微镜下检测SYP表达水平。
1.5 SYP、p-MEK、p-ERK1和p-ERK2的Western blot分析
采用BCA法测定蛋白质含量,进行SDS-聚丙烯酰胺凝胶电泳,PAGE凝胶中蛋白质电转移至硝酸纤维素膜上,用脱脂奶粉封闭。放入SYP、p-MEK、p-ERK1和p-ERK2的一抗中(1∶500) 4 ℃杂交过夜。将PVDF膜经TBST漂洗3次后放入鼠二抗(1∶500)孵育1~2 h。取出PVDF膜,TBST冲洗后,吸去多余液体,铺于玻璃板上。将ECL试剂盒内的detection reagent 1与detection reagent 2等体积混合后,均匀滴在PVDF膜上,反应1~2 min。化学发光凝胶系统分析仪显示、拍照,采用Visionworks 6.3.3. 图像采集及分析软件对蛋白条带光密度进行分析。实验重复3次。
1.6 统计学分析
采用SPSS 12.0软件进行数据分析,实验数据采用(x±s)表示,采用One-Way ANOVA和LSD′s post hoc test进行统计学分析, P < 0.05为差异有统计学意义。
2. 结果
2.1 SV增强皮层神经元SYP免疫反应性
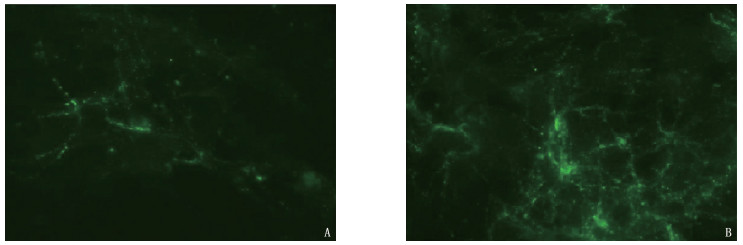
免疫荧光检测显示,在对照组大鼠大脑皮层神经元中, SYP表达呈散点状,点状细小颗粒连接成细丝,荧光强度较弱; 经4 μmol/L SV处理48 h的神经元SYP表达明显增多,散状点小颗粒相互连接成丝,细丝交织在一起呈网状分布,荧光强度明显增加。见图 1。
2.2 SV浓度依赖性上调皮层神经元SYP水平
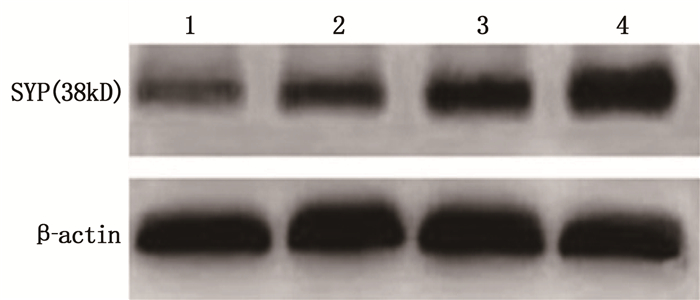
对加入不同浓度(2、4、8 μmol/L)SV培养4 d的大鼠皮层神经元进行Western blot检测显示,作用48 h后可显著增高SYP表达水平,并呈浓度依赖性,即8 μmol/L SV对SYP的增高作用最为显著。见图 2、表 1。
表 1 不同浓度SV对大鼠皮层神经元SYP水平的影响(x±s)(n=3)组别 给药剂量 光密度比值/(SYP/β-actin) 对照组 — 0.329±0.032 SV处理组 2 μmol/L 0.559±0.030** 4 μmol/L 0.759±0.036** 8 μmol/L 0.924±0.029** 与对照组比较, **P < 0.01。 2.3 阻断MEK/ERK信号通路抑制SV对SYP的上调
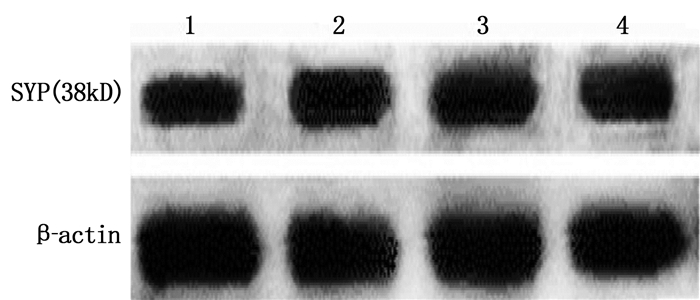
Western blot检测显示, 8 μmol/L SV处理可显著增高大鼠皮层神经元内SYP水平; 在8 μmol/L SV处理的神经元中应用MEK和ERK的特异性阻断剂PD98059处理,可减少SV引起的SYP水平增高,但在未用SV处理的神经元中单独应用PD98059并不能使SYP水平降低。由此可见, SV可能是通过MEK/ERK信号通路上调SYP水平。见图 3、表 2。
表 2 PD98059对各组皮层神经元中SYP水平的影响(x±s)组别 给药剂量 光密度比值/(SYP/β-actin) 对照组 — 0.774±0.038** SV处理组 8 μmol/L 1.393±0.036 SV+PD98059处理组 10 μmol/L+10 μmol/L 0.801±0.035 ** PD98059处理组 10 μmol/L 0.756±0.033 与SV处理组比较, **P < 0.01。 2.4 阻断MEK/ERK信号通路抑制SV对MEK、ERK1和ERK2磷酸化的上调
Western blot检测显示, 8 μmol/L SV处理可显著增高大鼠皮层神经元中p-MEK、p-ERK1和p-ERK2水平; PD98059可抑制SV引起的p-MEK、p-ERK1和p-ERK2水平增高; 单独应用PD98059对p-MEK和p-MEK2蛋白表达水平无影响,但可降低p-ERK1水平。由此可见, SV对神经元SYP蛋白表达的促进作用可能与MEK/ERK介导的p-MEK、p-ERK1和p-ERK2上调有关。
3. 讨论
神经退行性疾病患者脑内前皮质中突触蛋白水平的降低程度比其他大脑区域更为严重,此区域与推理、计划和抽象思考等重要大脑功能密切相关[11-12]。突触蛋白是一组与突触相关的具有神经元特异性的磷酸蛋白,主要分布于神经终末处, SYP主要特异性地分布于突触前囊泡膜上,参与突触后信号转导,在突触可塑性等方面发挥重要作用。研究[7]报道, SYP是突触蛋白家族中最先出现在培养体外皮层神经元生长阶段并呈高水平表达。
表 3 PD98059对各组皮层神经元中p-MEK、p-ERK1和p-ERK2水平的影响(x±s)(n=3)组别 给药剂量 p-MEK蛋白/β-actin p-ERK1蛋白/β-actin p-ERK2蛋白/β-actin 对照组 — 0.223±0.012 0.328±0.012 0.251±0.013 SV处理组 8 μmol/L 0.645±0.021** 0.694±0.015** 0.893±0.017** SV+PD98059处理组 10 μmol/L+10 μmol/L 0.305±0.013# # 0.361±0.013# # 0.357±0.014# # PD98059处理组 10 μmol/L 0.209±0.011 0.200±0.014* 0.249±0.012 与对照组比较, *P < 0.05, **P < 0.01; 与SV处理组比较, ##P < 0.01。 丝裂原活化蛋白激酶(MAPK)信号转导通路主要包括3大类,分别是MAPK kinase kinase(MAPKKK)、MAPK kinase(MAPKK)和MAPK, 这3大类MAPK级联反应在哺乳动物应激信号转导中与各类上游信号及级联过程的酶共同作用[13]。MAPK/ERK信号转导通路即Ras/Raf/ERK1/2信号通路,与多种疾病密切相关,激活的Ras可以募集并激活下游相应的激酶,如MAP/ERK激酶、Raf和ERK等,最终调节控制细胞的各种反应[8]。MEK和ERK均分为2个亚型,即MEK1、MEK2和ERK1、ERK2。MEK待苏氨酸残基被其磷酸化后,可进一步激活其下游底物ERK。MEK1/2和ERK1/2均是MEK/ERK信号通路中重要的激酶蛋白。MEK被上游相应激酶磷酸化后活化,然后再次磷酸化后活化其下游激酶ERK[14-15],表明磷酸化是信号转导通路活化作用不可缺少的重要因素[16]。ERK活化后进入到细胞核内,进一步诱导产生各种生物学效应,包括细胞生长、发育、分化及凋亡等[9-12]。研究[17]证实,ERK信号通路与脑内长时程增强(LTP)的形成以及学习记忆功能有密切联系。研究[18]报道在交感神经细胞中,磷酸化的ERK1/2具有保护效应,可促进大鼠神经细胞轴突存活; 在海马神经元中, ERK能够被其上游激酶MEK激活,与神经元突触可塑性如学习、记忆及生物学反应有关。
本实验应用SV处理皮层神经元,免疫荧光显示SV能明显促进SYP表达, Western blot半定量进一步证明了这种促进作用,并呈一定剂量依赖性。ERK的抑制剂PD98059不仅能抑制ERK, 也能抑制MEK, 从而抑制ERK的功能[8-9]。作者应用MEK/ERK的阻断剂PD98059抑制ERK及MEK, 结果显示PD98059可明显阻断SV引起的SYP水平上调,说明SV的促进作用与MEK/ERK信号通路有关。ERK的激活参与维持神经元树枝状的形态[4], 作者进一步检测了MEK/ERK下游的2个蛋白磷酸化水平,并应用PD98059阻断MEK/ERK信号通路,结果发现SV同样可以对抗PD98059所致的p-MEK、p-ERK1和p-ERK2表达的减少。上述结果提示, SV通过MEK/ERK信号转导上调SYP表达。ERK信号通路能够调节细胞的生长、分化及存活。体外实验[13-15]发现, ERK能够通过调控神经突触相关功能蛋白,参与海马神经细胞新树突棘的生成,提示ERK可能参与神经元形态改变过程。MEK/ERK通路对机械性外伤损伤所致的神经元凋亡具有保护作用, PI3K/AKT和ERK通路的活化均参与抵抗神经酰胺诱导的皮层神经元凋亡[19-20]。本实验也发现SV通过ERK信号通路促进SYP表达,进而促进细胞生长发育,与刘红兵等[13]研究结果一致。研究[14-15]表明, MEK/ERK阻断剂U0126通过抑制ERK1/2的激活,进而能够抑制谷氨酸引起的神经元损伤,多巴胺引起的神经元死亡也与ERK1/2有关[16]。由此可见, ERK1/2在神经元的生长发育过程中也可能具有促进细胞死亡的作用。
综上所述, SV能激活MEK/ERK信号转导通路,上调SYP、p-MEK、p-ERK1和p-ERK2蛋白表达水平,并能对抗阻断剂导致的蛋白表达下降。研究[21]表示持续的ERK信号激活会促使细胞凋亡,而短暂的ERK信号激活则能够促使细胞存活,可见MEK/ERK信号转导通路对神经元的作用具有多向性,其相关机制还有待进一步研究。
-
表 1 不同浓度SV对大鼠皮层神经元SYP水平的影响(x±s)(n=3)
组别 给药剂量 光密度比值/(SYP/β-actin) 对照组 — 0.329±0.032 SV处理组 2 μmol/L 0.559±0.030** 4 μmol/L 0.759±0.036** 8 μmol/L 0.924±0.029** 与对照组比较, **P < 0.01。 表 2 PD98059对各组皮层神经元中SYP水平的影响(x±s)
组别 给药剂量 光密度比值/(SYP/β-actin) 对照组 — 0.774±0.038** SV处理组 8 μmol/L 1.393±0.036 SV+PD98059处理组 10 μmol/L+10 μmol/L 0.801±0.035 ** PD98059处理组 10 μmol/L 0.756±0.033 与SV处理组比较, **P < 0.01。 表 3 PD98059对各组皮层神经元中p-MEK、p-ERK1和p-ERK2水平的影响(x±s)(n=3)
组别 给药剂量 p-MEK蛋白/β-actin p-ERK1蛋白/β-actin p-ERK2蛋白/β-actin 对照组 — 0.223±0.012 0.328±0.012 0.251±0.013 SV处理组 8 μmol/L 0.645±0.021** 0.694±0.015** 0.893±0.017** SV+PD98059处理组 10 μmol/L+10 μmol/L 0.305±0.013# # 0.361±0.013# # 0.357±0.014# # PD98059处理组 10 μmol/L 0.209±0.011 0.200±0.014* 0.249±0.012 与对照组比较, *P < 0.05, **P < 0.01; 与SV处理组比较, ##P < 0.01。 -
[1] 王晓燕, 侯爱生, 宋玉祥, 等. 小鼠学习记忆能力及海马区突触功能相关蛋白BDNF、PSD95、GluA1的增龄性变化[J]. 解放军医学院学报, 2020, 41(8): 808-812, 837. doi: 10.3969/j.issn.2095-5227.2020.08.014 [2] COULOMBE P, MELOCHE S. Atypical mitogen-activated protein kinases: structure, regulation and functions[J]. Biochim Biophys Acta, 2007, 1773(8): 1376-1387. doi: 10.1016/j.bbamcr.2006.11.001
[3] 钱旭东, 王东, 徐倩倩, 等. 艾地苯醌改善血管性痴呆大鼠认知功能及其对海马区生长相关蛋白-43和突触素P38表达的影响[J]. 神经损伤与功能重建, 2019, 14(12): 611-613. https://www.cnki.com.cn/Article/CJFDTOTAL-GWKF201912004.htm [4] SONG G, OUYANG G L, BAO S D. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cellular Mol Med, 2005, 9(1): 59-71. doi: 10.1111/j.1582-4934.2005.tb00337.x
[5] MIÑANO A, XIFRÓX, PÉREZ V, et al. Estradiol facilitates neurite maintenance by a Src/Ras/ERK signalling pathway[J]. Mol Cell Neurosci, 2008, 39(2): 143-151. doi: 10.1016/j.mcn.2008.06.001
[6] ORTUÑO-SAHAGÙN D, GONZÁLEZ R M, VERDAGUER E, et al. Glutamate excitotoxicity activates the MAPK/ERK signaling pathway and induces the survival of rat hippocampal neurons in vivo[J]. J Mol Neurosci, 2014, 52(3): 366-377. doi: 10.1007/s12031-013-0157-7
[7] SANCHEZ A, TRIPATHY D, YIN X, et al. Pigment epithelium-derived factor (PEDF) protects cortical neurons in vitro from oxidant injury by activation of extracellular signal-regulated kinase (ERK) 1/2 and induction of Bcl-2[J]. Neurosci Res, 2012, 72(1): 1-8. doi: 10.1016/j.neures.2011.09.003
[8] KWON S E, CHAPMAN E R. Synaptophysin regulates the kinetics of synaptic vesicle endocytosis in central neurons[J]. Neuron, 2011, 70(5): 847-854. doi: 10.1016/j.neuron.2011.04.001
[9] 王东春, 肖红, 舒琴, 等. 百令胶囊联合辛伐他汀对2型糖尿病肾病患者氧化与抗氧化失衡及炎性介质水平的影响[J]. 解放军医药杂志, 2020, 32(9): 39-43. https://www.cnki.com.cn/Article/CJFDTOTAL-HBGF202009011.htm [10] 张海娜, 徐慧, 余旭奔, 等. 辛伐他汀对脂多糖诱导的小鼠抑郁行为及神经炎症的影响[J]. 中国药理学通报, 2017, 33(3): 373-378. doi: 10.3969/j.issn.1001-1978.2017.03.016 [11] 张洁琼, 刘闻一, 林森, 等. JIP1基因敲除对青年小鼠视网膜形态和突触蛋白表达的影响[J]. 第三军医大学学报, 2019, 41(6): 563-569. https://www.cnki.com.cn/Article/CJFDTOTAL-DSDX201906010.htm [12] 苏晓梅, 张丹参. 星形胶质细胞与神经退行性疾病的相关性[J]. 中国药理学与毒理学杂志, 2019, 33(10): 868-869. https://www.cnki.com.cn/Article/CJFDTOTAL-YLBS201910256.htm [13] 刘红兵, 青廉. MAPK信号通路系统与胃癌研究进展[J]. 中国现代普通外科进展, 2019, 22(12): 995-997, 1002. https://www.cnki.com.cn/Article/CJFDTOTAL-PWJZ201912024.htm [14] KLESSE L J, MEYERS K A, MARSHALL C J, et al. Nerve growth factor induces survival and differentiation through two distinct signaling cascades in PC12 cells[J]. Oncogene, 1999, 18(12): 2055-2068. doi: 10.1038/sj.onc.1202524
[15] STICOZZI C, BELMONTE G, MEINI A, et al. IL-1β induces GFAP expression in vitro and in vivo and protects neurons from traumatic injury-associated apoptosis in rat brain striatum via NFκB/Ca2+-calmodulin/ERK mitogen-activated protein kinase signaling pathway[J]. Neuroscience, 2013, 252: 367-383. doi: 10.1016/j.neuroscience.2013.07.061
[16] SHENG H, SHAO J, DUBOIS R N. Akt/PKB activity is required for Ha-Ras-mediated transformation of intestinal epithelial cells[J]. J Biol Chem, 2001, 276(17): 14498-14504. doi: 10.1074/jbc.M010093200
[17] LESUISSE C, MARTIN L J. Immature and mature cortical neurons engage different apoptotic mechanisms involving caspase-3 and the mitogen-activated protein kinase pathway[J]. J Cereb Blood Flow Metab, 2002, 22(8): 935-950. doi: 10.1097/00004647-200208000-00005
[18] 谭龙春, 赵亮, 邓成敏, 等. 洛伐他汀对大鼠海马神经元毒蕈碱样型乙酰胆碱受体的影响及与ERK信号通路的关系[J]. 贵州医科大学学报, 2017, 42(1): 1-6. https://www.cnki.com.cn/Article/CJFDTOTAL-GYYB201701001.htm [19] MCCUBREY J A, STEELMAN L S, CHAPPELL W H, et al. Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance[J]. Biochim et Biophys Acta BBA - Mol Cell Res, 2007, 1773(8): 1263-1284. doi: 10.1016/j.bbamcr.2006.10.001
[20] HUGHES R, GILLEY J, KRISTIANSEN M, et al. The MEK-ERK pathway negatively regulates bim expression through the 3' UTR in sympathetic neurons[J]. BMC Neurosci, 2011, 12: 69-77. doi: 10.1186/1471-2202-12-69
[21] 张折折, 吴永芳, 李学伟, 等. 中老年期CD-1小鼠海马突触蛋白Arc含量改变及其与认知功能下降的相关性研究[J]. 安徽农业大学学报, 2019, 46(3): 405-409. https://www.cnki.com.cn/Article/CJFDTOTAL-ANHU201903005.htm -
期刊类型引用(1)
1. 彭大云,吴晓莉,韩丽芳,庄洁娜,廖月媛,廖秋林. 基于iTRAQ技术对低级别胶质瘤与正常脑组织差异性表达蛋白的初步筛选研究. 临床医学研究与实践. 2024(08): 5-10 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号