Value of microcirculation resistance index in evaluating prognosis of patients with acute anterior ST-segment elevation myocardial infarction after emergency percutaneous coronary intervention andrelated influencing factors
-
摘要:目的 探讨微循环阻力指数(IMR)评估急性前壁ST段抬高型心肌梗死(STEMI)患者急诊冠状动脉介入治疗(PCI)预后的价值及影响因素。方法 选取行急诊PCI的急性前壁STEMI患者50例, 在PCI后立即测量IMR。以IMR=40 U为临界值,将IMR < 40 U定义为微循环正常组(A组),将IMR≥40 U定义为微循环异常组(B组)。分析2组患者一般资料、实验室检查结果、术中相关情况,以及术后24 h、术后6个月、术后12个月的超声心动图结果及术后随访12个月的主要心脏不良事件(MACE)情况。结果 Logistic回归分析发现,症状发作至球囊扩张时间(STB)是影响急性前壁STEMI患者微循环障碍的独立危险因素。在PCI术后24 h、6个月、12个月时, 2组左室射血分数(LVEF)、左室舒张末容积内径(LVEDD)比较,差异有统计学意义(P < 0.05)。2组患者MACE情况比较,差异有统计学意义(P < 0.05)。结论 STB是急性前壁STEMI患者微循环障碍的独立危险因素, IMR对急性前壁STEMI患者PCI术后左心重构、左心功能恢复及主要心脏不良事件的发生可能有较好的早期预测价值。
-
关键词:
- 急性ST段抬高型心肌梗死 /
- 微循环阻力指数 /
- 微循环障碍 /
- 急诊经皮冠状动脉介入治疗 /
- 心脏不良事件 /
- 左室射血分数
Abstract:Objective To investigate the value of microcirculation resistance index (IMR) in evaluating prognosis of patients with acute anterior ST-segment elevation myocardial infarction (STEMI) after emergency percutaneous coronary intervention (PCI) and related influencing factors.Methods Totally 50 patients with acute anterior STEMI by PCI were selected, and IMR was measured immediately after PCI. Taking IMR=40 U as the cutoff value, patients with IMR < 40 U was defined as normal microcirculation group (group A), and those with IMR≥40 U was defined as abnormal microcirculation group (group B). The general data, laboratory results, intraoperative information, and echocardiographic results at 24 hours, 6 months and 12 months after operation were analyzed. Major adverse cardiac events (MACE) at 12 months after operation were analyzed.Results Logistic regression analysis showed that time from onset of symptoms to balloon dilation (STB) was an independent risk factor for microcirculation disorders in acute anterior STEMI patients. At 24 hours, 6 months and 12 months after PCI, there were significant differences in the left ventricular ejection fraction (LVEF) and left ventricular end-diastolic volume diameter (LVEDD) between the two groups (P < 0.05). There was a significant difference in MACE between the two groups (P < 0.05).Conclusion STB is an independent risk factor for microcirculation disorders in acute anterior STEMI patients. IMR may have a good early predictive value for left ventricular remodeling, recovery of left cardiac function and incidence of MACE after PCI in acute anterior STEMI patients. -
急诊冠状动脉介入治疗(PCI)是急性前壁ST段抬高型心肌梗死(STEMI)患者的首选再灌注治疗方法[1], 其目标是尽早地、有效地开通梗死相关血管,实现心肌组织的再灌注。尽管梗死相关血管恢复了血流,但其急性心肌梗死溶栓血流(TIMI)分级已达3级,且研究[2-4]发现,由于冠状动脉微血管的损伤和功能障碍,相应心肌组织水平并未完全得到有效的再灌注,且与不良预后密切相关。研究[6-7]认为微循环阻力指数(IMR)是反映冠状动脉微循环的特异性指标[5], 并可预测STEMI患者的预后。本研究测量急性前壁STEMI患者急诊PCI后的IMR, 分析其影响因素以及在预后评估中的应用价值,现报告如下。
1. 资料与方法
1.1 一般资料
本研究收集2015年4月—2018年1月江苏省苏北人民医院心内科诊断为急性前壁STEMI行急诊PCI治疗后立即测量IMR的患者50例,其中男44例,女6例。纳入标准: ①符合国际通用诊断标准的急性前壁STEMI患者,发病12 h内,冠脉造影示前降支闭塞,前降支置入药物洗脱支架后TIMI血流3级; ②已签署知情同意书。排除标准: ①存在抗凝、抗血小板治疗的禁忌证; ②左主干病变或心源性休克; ③已接受溶栓治疗; ④对三磷酸腺苷、肝素、碘造影剂有过敏者; ⑤ Ⅱ度及以上房室传导阻滞且无心脏起搏保护; ⑥合并哮喘或慢性阻塞性肺疾病,或接受茶碱类、格列本脲治疗的其他心肌疾病; ⑦严重肝、肾功能不全; ⑧脑血管疾病; ⑨严重感染; ⑩甲状腺功能异常,免疫性疾病或恶性肿瘤或预期寿命 < 12月。
收集患者的临床资料,包括性别、年龄、既往史、入院时血压及心率、实验室检测指标、术中相关情况。术后24 h及术后6、12个月行超声心动图,测量患者的左室舒张末容积内径(LVEDD)、左室射血分数(LVEF), 其中LVEF测量采用Simpson双平面法。同时记录入选患者随访12个月内主要心脏不良事件(MACE)的发生情况,包括心源性死亡、恶性心律失常、靶血管血运重建和严重心力衰竭再次住院。
1.2 急诊PCI及IMR测量
术前常规双联抗血小板负荷量药物(阿司匹林肠溶片300 mg或替格瑞洛180 mg嚼服)。经桡动脉途径完成冠状动脉造影,根据前降支血栓负荷情况选择应用血栓抽吸和/或替罗非班,药物支架根据前降支管腔大小,以1∶1的原则选择,术中采用TIMI分级判断冠脉血流情况。支架置入完毕后,采用圣犹达医疗公司设计的压力导丝测量系统,按照操作流程进行IMR的测量[8-10]。术后所有患者均口服氯吡格雷75 mg (1次/d)或替格瑞洛90 mg (2次/d)至少1年,并长期口服阿司匹林肠溶片0.1 g (1次/d)双联抗血小板治疗及阿托伐他汀20 mg稳定斑块, 1次/晚,并根据患者血压及心率情况予β受体阻滞剂及血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)类药物。
1.3 研究分组
根据国外相关研究[11-12]均提示IMR>40 U为存在严重的微循环功能障碍,并与临床不良预后相关。本研究以IMR=40 U为临界值,将IMR < 40 U患者设为微循环正常组,即A组; 将IMR≥40 U患者设为微循环异常组,即B组。
1.4 统计学方法
采用SPSS 19.0软件进行统计学分析,计数资料使用[n(%)]表示,组间比较采用χ2检验或Fisher确切概率法。符合正态分布的计量资料,以均数±标准差表示,组间比较采用LSD-t检验。非正态分布的计量资料,应用中位数(四分位数)[M(P25, P75)]表示,组间比较使用Mann-Whitney U检验。将两组经单因素分析后有统计学意义的可能影响因素纳入二元Logistic回归分析。ROC曲线相关分析采用Medcalc软件进行分析。多时点观测资料行重复测量方差分析。P < 0.05为差异有统计学意义。
2. 结果
2.1 一般情况及实验室检测结果
50例急性前壁STEMI患者纳入最终分析, A、B组患者心率、收缩压、舒张压、性别、既往史(糖尿病史、高血压病史、吸烟史和高脂血症病史)等比较,差异均无统计学意义(P>0.05)。B组年龄≥65岁的患者比例显著高于A组(P < 0.05)。2组患者术前实验室检查指标如血红蛋白、血小板、肌酐、低密度脂蛋白胆固醇、尿酸、肌钙蛋白Ⅰ、肌红蛋白、D-二聚体等比较均无显著差异(P>0.05), 而A组肌酸激酶同工酶峰值、中性粒细胞计数与淋巴细胞计数比值显著低于B组(P < 0.05)。见表 1、2。
表 1 2组患者一般资料比较(x±s)[n(%)]指标 A组(n=28) B组(n=22) 年龄/岁 <65 21(75.00) 9(40.91)* ≥65 7(25.00) 13(59.09)* 心率/(次/min) 76.50±14.74 76.05±14.69 收缩压/mmHg 135.96±20.46 125.73±20.09 舒张压/mmHg 82.96±12.95 80.78±12.69 性别 男 25(89.29) 18(81.82) 女 3(10.71) 4(18.18) 糖尿病史 无 17(60.71) 16(72.73) 有 11(39.29) 6(27.27) 高血压病史 无 9(32.14) 11(50.00) 有 19(67.86) 11(50.00) 吸烟史 无 9(32.14) 5(22.73) 有 19(67.86) 17(77.27) 高脂血症病史 无 23(82.14) 16(72.73) 有 5(17.86) 6(27.27) 与A组比较, *P < 0.05。 表 2 2组患者实验室检查结果比较(x±s)指标 A组(n=28) B组(n=22) HGB/(g/L) 147.00±17.29 138.05±21.02 PLT/(×109/L) 203.39±66.69 181.23±42.08 CREA/(μmol/L) 72.71±18.81 67.45±14.61 LDL-C/(mmol/L) 2.84±0.85 2.60±0.93 尿酸/(mmol/L) 335.57±82.99 340.27±91.44 cTnI/(ng/mL) 7.75(1.25, 24.90) 10.98(2.19, 26.54) CK-MB峰值/(ng/mL) 12.90(4.00, 48.09) 44.08(13.65, 72.75)* MYO/(ng/mL) 124.60(75.12, 298.48) 298.21(75.89, 637.89) D-D/(mg/L) 0.26(0.17, 0.42) 0.35(0.18, 0.60) NLR 4.6(2.52, 7.55) 8.69(5.42, 12.31)* HGB: 血红蛋白; PLT: 血小板计数; CREA: 肌酐;
LDL-C: 低密度脂蛋白胆固醇; cTnI: 肌酐蛋白I;
CK-MB: 肌酸激酶同工酶; MYO: 肌红蛋白; D-D: D-二聚体;
NLR: 中性粒细胞计数与淋巴细胞计数比值。与A组比较, *P < 0.05。2.2 2组患者手术相关资料比较
B组的症状发作至球囊扩张时间显著长于A组(P < 0.05), 而合并其他冠脉病变(包括合并回旋支病变,合并右冠病变及同时合并回旋及右冠病变)、术中用药(替罗非班、硝普钠)、血栓抽吸、支架长度、支架直径、球囊后扩比较无显著差异(P>0.05)。见表 3。
表 3 2组患者术中情况比较[n(%)]指标 A组(n=28) B组(n=22) 血栓抽吸 否 22(78.57) 16(72.73) 是 6(21.43) 6(27.27) 球囊后扩 否 16(57.14) 9(40.91) 有 12(47.14) 13(59.09) Ⅱb/Ⅲa受体拮抗剂 无 12(47.14) 8(36.36) 替罗非班 16(57.14) 14(63.64) 硝普钠 否 24(85.71) 17(77.27) 有 4(14.29) 5(22.73) 合并其他冠脉病变 合并回旋支病变 14(50.00) 7(31.82) 合并右冠病变 11(39.29) 8(36.36) 同时合并回旋支及右冠病变 9(32.14) 6(27.27) 支架长/mm 25(23.25, 32.25) 30(20.00, 38.25) 支架直径/mm 3(3.00, 3.50) 3(3.00, 3.50) STB/min 240(180.00, 300.00) 383(332.25, 525.00)* STB: 症状发作至球囊扩张时间; NLR: 中性粒细胞计数与淋巴细胞计数比值。与A组比较, *P < 0.05。 2.3 Logistic回归分析
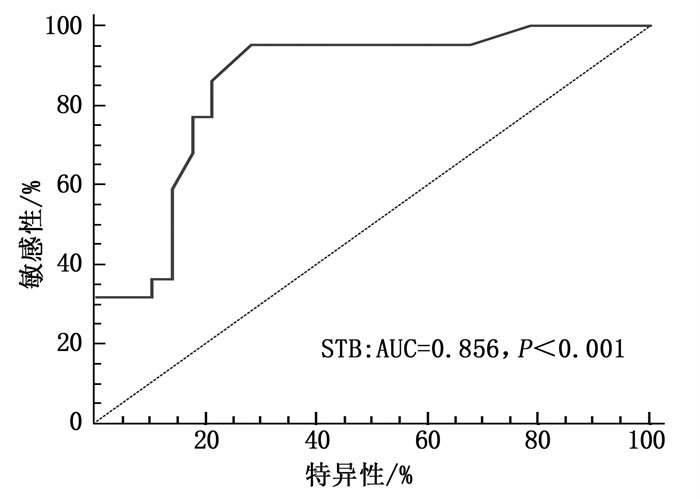
对CK-MB峰值、NLR、年龄和STB进行二元Logistic回归分析,结果提示, STB是发生微循环障碍的独立危险因素。回归模型预测的准确率为82.00%。STB的ROC曲线下的面积(AUC)为0.856(SE为0.055, P < 0.001, 95%CI为0.728~0.939)。结合AUC可知, STB的Youden指数为0.67, 最佳截断值为260 min, 敏感度95.45%, 特异度71.43%, 见表 4及图 1。
表 4 急性前壁STEMI患者发生微循环障碍的危险因素因素 B SE P OR 95%CI 下限 上限 年龄≥65岁 1.359 0.864 0.116 3.894 0.716 21.178 CK-MB峰值 0.006 0.006 0.307 1.006 0.995 1.017 NLR 0.206 0.123 0.093 1.229 0.966 1.563 STB 0.012 0.004 0.003 1.012 1.004 1.02 CK-MB: 肌酸激酶同工酶; STB: 症状发作至球囊扩张时间; NLR: 中性粒细胞计数与淋巴细胞计数比值。 2.4 2组患者术后心功能比较
A组术后24 h、术后6个月及术后12个月的LVEF、LVEDD值呈显著升高趋势(P < 0.05); B组LVEF值在术后6个月显著升高(P < 0.05), 而术后12个月较术后6个月显著下降(P < 0.05); B组术后24 h、术后6个月及术后12个月的LVEDD值呈显著升高趋势(P < 0.05)。B组术后24 h、术后6个月及术后12个月的LVEF值显著低于A组同期水平,而LVEDD值则显著高于A组同期水平(P < 0.05)。见表 5。
表 5 2组患者术后左心功能比较组别 时点 LVEF/% LVEDD/mm A组(n=28) 术后24 h 50.79±7.198 47.46±4.17 术后6个月 55.00±6.837# 47.43±3.75 术后12个月 56.32±6.700# 49.61±4.18#▲ B组(n=22) 术后24 h 43.59±6.284* 51.09±4.79* 术后6个月 49.41±10.477*# 51.14±5.83* 术后12个月 42.05±8.677*▲ 53.77±5.31*#▲ LVEF: 左室射血分数; LVEDD: 左室舒张末容积内径。
与A组相比, *P < 0.05; 与术后24 h相比, #P < 0.05;
与术后6个月相比, ▲P < 0.05。2.5 2组患者MACE发生情况比较
所有入选患者随访12个月均无心源性死亡、恶性心律失常及靶血管病变重建等不良事件发生,仅有9例(A组1例, B组8例)发生严重的心力衰竭再住院治疗, 2组差异有统计学意义(P < 0.05)。
3. 讨论
临床研究[13]发现,尽管开通了梗死相关血管,但仍有约1/3的患者因微循环功能障碍导致心肌得不到有效再灌注,影响预后恢复。再灌注治疗后微循环功能障碍的机制尚未明确,相关研究提示年龄、炎症指标、心肌坏死标记物及梗死相关血管开通时间对冠状动脉微循环功能障碍可能有早期的预测价值。本研究比较A、B组患者基线及临床特征,结果显示年龄、NLR、CK-MB峰值和STB共4项术前指标的差异有统计学意义,其中B组年龄≥65岁的患者比例显著高于A组,与Baekd等[14]研究中低IMR组的年龄显著低于中、高IMR组的结果一致,分析原因可能与患者年龄越大,冠脉病变程度越重,内皮功能也越差有关。近年来,炎症因子在心肌再灌注损伤中的作用颇受关注[15-17], Lee等[15]报道STEMI患者直接PCI后测量的IMR值与入院时NLR增高存在明显相关性,本研究也有同样发现。
CK-MB峰值是反映心肌梗死面积的指标, Fearon W F等[18]发现,相较于TIMI帧数、冠脉血流储备(CFR)和ST段回落情况等微循环评估方法, IMR仅与STEMI患者的CK-MB峰值显著相关。本研究B组CK-MB峰值显著高于A组,提示CK-MB峰值也能反映STEMI患者再灌注治疗后的冠状动脉微循环状态。有研究[14, 19-20]表明, STB与急性STEMI患者再灌注治疗后微循环功能状态的情况密切相关。本研究二元Logistic回归分析显示, STB是影响急性前壁STEMI患者微循环障碍的独立危险因素,提示缩短发病至首次医疗接触时间,并尽早开通梗死相关血管,对保护STEMI患者再灌注治疗后的心肌微循环功能至关重要。
有研究显示IMR值可预测直接PCI治疗的STEMI患者心功能恢复情况。Fearon W F等[18]研究发现,IMR与STEMI患者3个月后超声心动图室壁运动评分(WMS)显著相关,根据WMS的变化百分比,推测IMR是左心室功能恢复的唯一重要预测因子。本研究比较A、B组术后24 h、术后6个月及术后12个月LVEF和LVEDD, 结果发现A组(微循环正常患者)左心室重构较轻,心功能恢复相对较好,提示IMR作为冠状动脉微循环的特异指标,在STEMI患者直接PCI术后即刻测得值,能早期预测患者中、远期左心功能情况。Park等[21]发现用IMR和CFR评估微循环可以评价STEMI患者的心肌存活度和的长期预后。Fearon等[12]研究发现IMR>40 U的患者1年时心力衰竭病死率或再住院率高于IMR≤40 U的患者。本研究50例患者随访12个月无心源性死亡及再发心肌梗死事件发生,有9例因心力衰竭再住院治疗,其中B组8例, A组1例,差异有统计学意义。本研究结果提示IMR也可作为STEMI患者PCI术后中、远期临床不良预后的评估指标。
综上所述,本研究结果显示, IMR是判断冠脉微循环障碍的特异指标,多重因素与IMR相关,其中症状发作至球囊扩张的时间是影响急性前壁STEMI患者微循环障碍的独立危险因素。应用年龄、CK-MB峰值、NLR、STB构建的模型能较为准确地预测急性前壁STEMI患者发生微循环障碍的风险。综上所述, IMR可预测急性前壁STEMI患者PCI术后左心重构、左心功能恢复情况及主要心脏不良事件的发生。
-
表 1 2组患者一般资料比较(x±s)[n(%)]
指标 A组(n=28) B组(n=22) 年龄/岁 <65 21(75.00) 9(40.91)* ≥65 7(25.00) 13(59.09)* 心率/(次/min) 76.50±14.74 76.05±14.69 收缩压/mmHg 135.96±20.46 125.73±20.09 舒张压/mmHg 82.96±12.95 80.78±12.69 性别 男 25(89.29) 18(81.82) 女 3(10.71) 4(18.18) 糖尿病史 无 17(60.71) 16(72.73) 有 11(39.29) 6(27.27) 高血压病史 无 9(32.14) 11(50.00) 有 19(67.86) 11(50.00) 吸烟史 无 9(32.14) 5(22.73) 有 19(67.86) 17(77.27) 高脂血症病史 无 23(82.14) 16(72.73) 有 5(17.86) 6(27.27) 与A组比较, *P < 0.05。 表 2 2组患者实验室检查结果比较(x±s)
指标 A组(n=28) B组(n=22) HGB/(g/L) 147.00±17.29 138.05±21.02 PLT/(×109/L) 203.39±66.69 181.23±42.08 CREA/(μmol/L) 72.71±18.81 67.45±14.61 LDL-C/(mmol/L) 2.84±0.85 2.60±0.93 尿酸/(mmol/L) 335.57±82.99 340.27±91.44 cTnI/(ng/mL) 7.75(1.25, 24.90) 10.98(2.19, 26.54) CK-MB峰值/(ng/mL) 12.90(4.00, 48.09) 44.08(13.65, 72.75)* MYO/(ng/mL) 124.60(75.12, 298.48) 298.21(75.89, 637.89) D-D/(mg/L) 0.26(0.17, 0.42) 0.35(0.18, 0.60) NLR 4.6(2.52, 7.55) 8.69(5.42, 12.31)* HGB: 血红蛋白; PLT: 血小板计数; CREA: 肌酐;
LDL-C: 低密度脂蛋白胆固醇; cTnI: 肌酐蛋白I;
CK-MB: 肌酸激酶同工酶; MYO: 肌红蛋白; D-D: D-二聚体;
NLR: 中性粒细胞计数与淋巴细胞计数比值。与A组比较, *P < 0.05。表 3 2组患者术中情况比较[n(%)]
指标 A组(n=28) B组(n=22) 血栓抽吸 否 22(78.57) 16(72.73) 是 6(21.43) 6(27.27) 球囊后扩 否 16(57.14) 9(40.91) 有 12(47.14) 13(59.09) Ⅱb/Ⅲa受体拮抗剂 无 12(47.14) 8(36.36) 替罗非班 16(57.14) 14(63.64) 硝普钠 否 24(85.71) 17(77.27) 有 4(14.29) 5(22.73) 合并其他冠脉病变 合并回旋支病变 14(50.00) 7(31.82) 合并右冠病变 11(39.29) 8(36.36) 同时合并回旋支及右冠病变 9(32.14) 6(27.27) 支架长/mm 25(23.25, 32.25) 30(20.00, 38.25) 支架直径/mm 3(3.00, 3.50) 3(3.00, 3.50) STB/min 240(180.00, 300.00) 383(332.25, 525.00)* STB: 症状发作至球囊扩张时间; NLR: 中性粒细胞计数与淋巴细胞计数比值。与A组比较, *P < 0.05。 表 4 急性前壁STEMI患者发生微循环障碍的危险因素
因素 B SE P OR 95%CI 下限 上限 年龄≥65岁 1.359 0.864 0.116 3.894 0.716 21.178 CK-MB峰值 0.006 0.006 0.307 1.006 0.995 1.017 NLR 0.206 0.123 0.093 1.229 0.966 1.563 STB 0.012 0.004 0.003 1.012 1.004 1.02 CK-MB: 肌酸激酶同工酶; STB: 症状发作至球囊扩张时间; NLR: 中性粒细胞计数与淋巴细胞计数比值。 表 5 2组患者术后左心功能比较
组别 时点 LVEF/% LVEDD/mm A组(n=28) 术后24 h 50.79±7.198 47.46±4.17 术后6个月 55.00±6.837# 47.43±3.75 术后12个月 56.32±6.700# 49.61±4.18#▲ B组(n=22) 术后24 h 43.59±6.284* 51.09±4.79* 术后6个月 49.41±10.477*# 51.14±5.83* 术后12个月 42.05±8.677*▲ 53.77±5.31*#▲ LVEF: 左室射血分数; LVEDD: 左室舒张末容积内径。
与A组相比, *P < 0.05; 与术后24 h相比, #P < 0.05;
与术后6个月相比, ▲P < 0.05。 -
[1] De Maria G L, Cuculi F, Patel N, et al. How does coronary stent implantation impact on the status of the microcirculation during primary percutaneous coronary intervention in patients with ST-elevation myocardial infarction[J]. European Heart Journal, 2015, 36(45): 3165-3177. doi: 10.1093/eurheartj/ehv353
[2] Cuculi F, De Maria G L, Meier P, et al. Impact of Microvascular Obstruction on the Assessment of Coronary Flow Reserve, Index of Microcirculatory Resistance, and Fractional Flow Reserve After ST-Segment Elevation Myocardial Infarction[J]. Journal of the American College of Cardiology, 2014, 64(18): 1894-1904. doi: 10.1016/j.jacc.2014.07.987
[3] Fiarresga A, Selas M, Oliveira E, et al. Invasive assessment of the coronary microcirculation using the index of microcirculatory resistance: Description and validation of an animal model[J]. Rev Port Cardiol, 2014, 34(4): 207-212. http://www.sciencedirect.com/science/article/pii/S217420491400097X
[4] Bonello L, Ait M O, Lemesle G, et al. Incidence and predictors of microvascular dysfunction assessed by the index of microcirculatory resistance following primary PCI for ST-elevation myocardial infarction[J]. Int J Cardiol, 2011, 146(3): 465-467. doi: 10.1016/j.ijcard.2010.10.134
[5] Ng M K C, Yeung A C, Fearon W F. Invasive Assessment of the Coronary Microcirculation Superior Reproducibility and Less Hemodynamic Dependence of Index of Microcirculatory Resistance Compared With Coronary Flow Reserve[J]. Circulation, 2006, 113(17): 2054-2061. doi: 10.1161/CIRCULATIONAHA.105.603522
[6] Faustino M, Baptista S B, Freitas A, et al. The Index of Microcirculatory Resistance as a Predictor of Echocardiographic Left Ventricular Performance Recovery in Patients With ST-Elevation Acute Myocardial Infarction Undergoing Successful Primary Angioplasty[J]. Journal of Interventional Cardiology, 2016, 29(2): 137-145. doi: 10.1111/joic.12278
[7] Park S, Baek Y, Lee M, et al. Comprehensive assessment of microcirculation after primary percutaneous intervention in ST-segment elevation myocardial infarction: insight from thermodilution-derived index of microcirculatory resistance and coronary flow reserve[J]. Coronary Artery Disease, 2016, 27(1): 34-39. doi: 10.1097/MCA.0000000000000310
[8] 王世超, 刘玉昊, 武越, 等. 微循环阻力指数对冠状动脉完全闭塞病变择期行介入治疗的预测价值及影响因素[J]. 中国循环杂志, 2016(4): 332-336. doi: 10.3969/j.issn.1000-3614.2016.04.005 [9] Park S, Baek Y, Lee M, et al. Comprehensive assessment of microcirculation after primary percutaneous intervention in ST-segment elevation myocardial infarction[J]. Coronary Artery Disease, 2016, 27(1): 34-39. doi: 10.1097/MCA.0000000000000310
[10] Ahmed N, Layland J, Carrick D, et al. Safety of guidewire-based measurement of fractional flow reserve and the index of microvascular resistance using intravenous adenosine in patients with acute or recent myocardial infarction[J]. International Journal of Cardiology, 2016, 202: 305-310. doi: 10.1016/j.ijcard.2015.09.014
[11] De Maria G L, Alkhalil M, Wolfrum M, et al. Index of microcirculatory resistance as a tool to characterize microvascular obstruction and to predict infarct size regression in patients with STEMI undergoing primary PCI[J]. JACC Cardiovasc Imaging, 2019, 12(5): 837-848. doi: 10.1016/j.jcmg.2018.02.018
[12] Fearon W F, Low A F, Yong A S, et al. Prognostic Value of the Index of Microcirculatory Resistance Measured After Primary Percutaneous Coronary Intervention[J]. Circulation, 2013, 127(24): 2436-2441. doi: 10.1161/CIRCULATIONAHA.112.000298
[13] Palmer S, Layland J, Carrick D, et al. The Index of Microcirculatory Resistance Postpercutaneous Coronary Intervention Predicts Left Ventricular Recovery in Patients With Thrombolyzed ST-Segment Elevation Myocardial Infarction[J]. Journal of Interventional Cardiology, 2016, 29(2): 146-154. doi: 10.1111/joic.12271
[14] Baek Y, Park S, Kim S, et al. Clinical and Angiographic Predictors of Microvascular Dysfunction in ST-Segment Elevation Myocardial Infarction[J]. Yonsei Medical Journal, 2015, 56(5): 1235-1239. doi: 10.3349/ymj.2015.56.5.1235
[15] Lee M, Park S, Kwon S W, et al. Relation Between Neutrophil-to-Lymphocyte Ratio and Index of Microcirculatory Resistance in Patients With ST-Segment Elevation Myocardial Infarction Undergoing Primary Percutaneous Coronary Intervention[J]. The American Journal of Cardiology, 2016, 118(9): 1323-1328. doi: 10.1016/j.amjcard.2016.07.072
[16] Pan W, Zhao D, Zhang C, et al. Application of neutrophil/lymphocyte ratio in predicting coronary blood flow and mortality in patients with ST-elevation myocardial infarction undergoing percutaneous coronary intervention[J]. Journal of Cardiology, 2015, 66(1): 9-14. doi: 10.1016/j.jjcc.2014.10.014
[17] Park J J, Jang H, Oh I, et al. Prognostic Value of Neutrophil to Lymphocyte Ratio in Patients Presenting With ST-Elevation Myocardial Infarction Undergoing Primary Percutaneous Coronary Intervention[J]. The American Journal of Cardiology, 2013, 111(5): 636-642. doi: 10.1016/j.amjcard.2012.11.012
[18] Fearon W F, Shah M, Ng M, et al. Predictive Value of the Index of Microcirculatory Resistance in Patients With ST-Segment Elevation Myocardial Infarction[J]. Journal of the American College of Cardiology, 2008, 51(5): 560-565. doi: 10.1016/j.jacc.2007.08.062
[19] Sabin P, Koshy A G, Gupta P N, et al. Predictors of no- reflow during primary angioplasty for acute myocardial infarction, from Medical College Hospital, Trivandrum[J]. Indian Heart Journal, 2017, 69: S34-S45. http://www.sciencedirect.com/science/article/pii/S0019483216304205
[20] 魏腾飞, 赵蓓, 刘佩林, 等. 发病至首次医疗接触时间对急性ST段抬高型心肌梗死患者预后影响的研究[J]. 中华心血管病杂志, 2017, 45(5): 393-398. doi: 10.3760/cma.j.issn.0253-3758.2017.05.006 [21] Park S, Baek Y, Lee M, et al. Comprehensive assessment of microcirculation after primary percutaneous intervention in ST-segment elevation myocardial infarction[J]. Coronary Artery Disease, 2016, 27(1): 34-39. doi: 10.1097/MCA.0000000000000310




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号